1
Paul W, et al. :Br J Pharmacol. 1993;110:1565-71.
2
Umemura K, et al. :Clin Pharmacol Drug Dev. 2016;5:548-51.
3
造血幹細胞移植後の肝中心静脈閉塞症患者における薬物動態(承認年月日:2019年6月18日、CTD 2.7.6.5)
4
造血幹細胞移植後の肝中心静脈閉塞症患者における薬物動態(承認年月日:2019年6月18日、CTD 2.7.6.6)
5
血漿タンパク結合に関する検討(承認年月日:2019年6月18日、CTD 2.7.2.2)
6
代謝に関する検討(承認年月日:2019年6月18日、CTD 2.7.2.2)
7
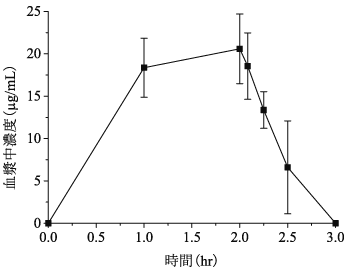
健康成人における薬物動態(承認年月日:2019年6月18日、CTD 2.7.2.2)
8
健康成人における薬物動態(承認年月日:2019年6月18日、CTD 2.7.6.3)
9
Tocchetti P, et al. :Drug Des Devel Ther. 2016;10:2631-41.
10
国内第II相試験(承認年月日:2019年6月18日、CTD 2.7.6.5)
11
Richardson P, et al. :Blood. 2016;127:1656-65.
12
フルダラビン誘発アポトーシスにおける活性型カスパーゼ-3量に対する作用(承認年月日:2019年6月18日、CTD 2.6.2.2.1.3)
13
プラスミン活性に対する作用(承認年月日:2019年6月18日、CTD 2.6.2.2.2.3)
14
Falanga A, et al. :Leukemia. 2003;17:1636-42.
15
Zhou Q, et al. :Thromb Haemost. 1994;71:507-10.
16
Palomo M, et al. :Biol Blood Marrow Transplant. 2011;17:497-506.
17
Cella G, et al. :Clin Appl Thromb Hemost. 2001;7:225-8.
18
Pescador R, et al. :Vascul Pharmacol. 2013;59:1-10.
19
血清飢餓による細胞障害に対する作用(承認年月日:2019年6月18日、CTD 2.6.2.2.1.1)
20
フルダラビン誘発アポトーシスに対する作用(承認年月日:2019年6月18日、CTD 2.6.2.2.1.2)