1
Danese MD, et al.:Adv Ther. 2022;39:2778-2795
2
MID-NETⓇを用いた調査結果の概要(G-CSF製剤と血小板減少との関連に関する薬剤疫学調査):https://www.pmda.go.jp/files/000234445.pdf
3
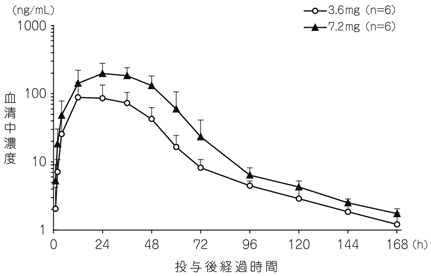
社内資料:健康成人を対象とした第Ⅱ相臨床試験(2022年2月25日承認、CTD2.7.2.2.1)
4
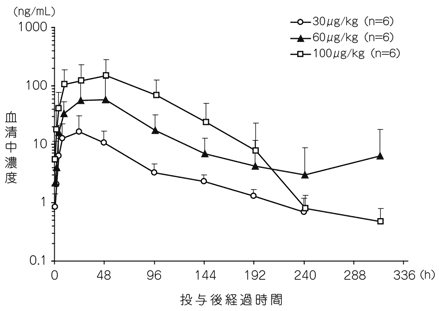
社内資料:肺癌患者を対象とした第Ⅰ相臨床薬理試験(2014年9月26日承認、CTD2.7.6.2)
5
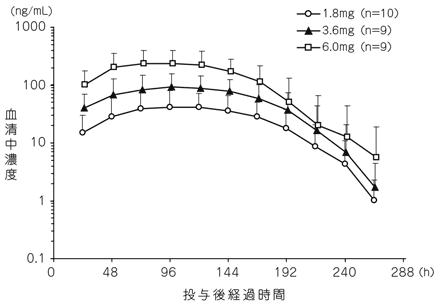
社内資料:悪性リンパ腫患者を対象とした用量設定試験(2014年9月26日承認、CTD2.7.6.10)
6
社内資料:悪性リンパ腫患者を対象とした第Ⅱ相試験(2014年9月26日承認、CTD2.7.6.3)
7
社内資料:ラットにおける組織中濃度(2014年9月26日承認、CTD2.6.4.4.1)
8
Yang BB, et al.:Clin Pharmacokinet. 2011; 50: 295-306
9
社内資料:悪性リンパ腫患者を対象とした第Ⅲ相臨床試験(2014年9月26日承認、CTD2.7.6.4)
10
社内資料:乳癌患者を対象とした第Ⅲ相臨床試験(2014年9月26日承認、CTD2.7.6.5)
11
社内資料:健康成人を対象とした第Ⅱ相試験(2022年2月25日承認、CTD2.7.6.3)
12
社内資料:薬理試験(顆粒球・マクロファージ系コロニー形成試験)(2014年9月26日承認、CTD2.6.2.2)
13
社内資料:薬理試験(抗がん剤に起因する好中球減少改善試験)(2014年9月26日承認、CTD2.6.2.2)