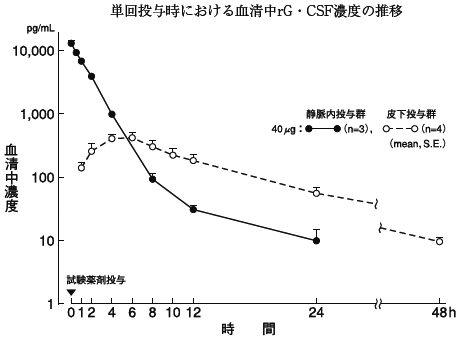
1
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書:フィルグラスチム(遺伝子組換え)及びレノグラスチム(遺伝子組換え)(再発又は難治性の急性骨髄性白血病に対する抗悪性腫瘍剤との併用療法)
2
関野久之, 他. 診療と新薬. 1989;26(11):1660-732.
3
Linch DC, et al. Br J Haematol. 1997;99:933-8.
4
Narabayashi M, et al. Jpn J Clin Oncol. 1999;29:285-90.
5
Van Hoef MEHM, et al. Ann Oncol. 1994;5:217-24.
6
Carella AM, et al. Br J Haematol. 1998;101:111-8.
7
Reiffers J, et al. Br J Haematol. 1998;102:639-46.
8
大西明弘, 他. 臨床血液. 2000;41(3):198-205.
9
Höglund M, et al. Bone Marrow Transplant. 1996;18:19-27.
10
Höglund M, et al. Eur J Haematol. 1997;59:177-83.
11
浅野茂隆, 他. 今日の移植. 1990;3(4):317-24.
12
尾山淳, 他. 日本癌治療学会誌. 1990;25(10):2533-48.
13
尾山淳, 他. Biotherapy. 1990;4(5):1045-52.
14
福岡正博, 他. Biotherapy. 1990;4(5):1038-44.
15
Ohno R, et al. Int J Hematol. 1993;58(1-2):73-81.
16
平嶋邦猛, 他. Biotherapy. 1993;7(9):1321-8.
17
高橋聡, 他. Biotherapy. 1997;11(8):923-9.
18
竹下明裕, 他. 臨床血液. 1995;36(6):606-14.
19
中島秀明, 他. 臨床血液. 1995;36(6):597-605.
20
木村之彦, 他. 臨床血液. 1995;36(6):589-96.
21
Takeshita A, et al. Int J Hematol. 2000;71:136-43.
22
古武敏彦, 他. 泌尿器外科. 1994;7(10):1123-33.
23
澤木修二, 他. Biotherapy. 1999;13(6):711-20.
24
冨永健, 他. Biotherapy. 1993;7(12):1709-16.
25
浅野茂隆, 他. Biotherapy. 1990;4(10):1644-51.
26
吉田弥太郎, 他. 臨床血液. 1991;32(7):743-50.
27
南谷幹夫, 他. 臨床とウイルス. 1996;24(5):399-408.
28
太田和夫, 他. 移植. 1995;30(1):30-46.
29
Kubota N, et al. J Biochem. 1990;107(3):486-92.
30
Oheda M, et al. J Biochem. 1988;103(3):544-6.
31
浅野茂隆. 造血因子. 1990;1(1):63-78.
32
社内資料:今井信雄, 他:コロニー形成法による各種造血前駆細胞への影響(1989)
33
工藤千恵, 他:マウスにおける幹細胞動員効果(2000年9月22日承認、申請資料概要ホ)
34
赤松健一, 他. 薬理と治療. 1990;18(Suppl.9):2487-526.
35
赤松健一, 他. 薬理と治療. 1990;18(Suppl.9):2535-50.
36
田村政彦, 他. 薬理と治療. 1990;18(Suppl.9):2469-77.
37
Matsumoto M, et al. Microbiol Immunol. 1990;34(9):765-73.
38
Matsumoto M, et al. J Antimicrob Chemother. 1991;28(3):447-53.
39
Tamura M, et al. Leukemia. 1991;5(12):1043-9.
40
社内資料:山下泰弘, 他:宿主対移植片反応における免疫抑制剤のin vivo効果に対する影響(1995)