1
ACC/AHA Guidelines for the Management of Patients With Acute Myocardial Infarction:J. Am. Coll. Cardiol., 1996;28(5):1328‐1419[BF‐0001]
2
日本小児循環器学会,川崎病急性期治療のガイドライン,2003[BF‐0225]
3
日本循環器学会,日本心臓病学会,日本小児科学会,日本小児循環器学会,日本胸部外科学会合同研究班,川崎病心臓血管後遺症の診断と治療に関するガイドライン:Circ. J., 2003;67 Suppl. IV:1111‐1152[BF‐0002]
4
赤木禎治ら:総合臨床,1995;44(10):2410‐2413[BF‐0003]
5
Sim, S.M. et al.:Br. J. Clin. Pharmac., 1991;32(1):17‐21[BF‐0004]
6
抗血小板薬(AP-1)の血中薬物動態試験報告書(ライオン株式会社社内資料)[BF‐0223]
7
Benedek, I.H. et al.:J. Clin. Pharmacol., 1995;35:1181‐1186[BF‐0005]
8
SAPAT:Lancet, 1992;340(8833):1421‐1424[BF‐0006]
9
Lewis, H.D. Jr. et al.:N. Engl. J. Med., 1983;309(7):396‐403[BF‐0007]
10
The RISC Group:Lancet, 1990;336(8719):827‐830[BF‐0008]
11
Antiplatelet Trialists’ Collaboration:Br. Med. J., 1994;308(6921):81‐106[BF‐0009]
12
Yasue, H. et al.:Am. J. Cardiol., 1999;83(9):1308‐1313[BF‐0010]
13
ISIS-2 Collaborative Group:Lancet, 1988;2(8607):349‐360[BF‐0011]
14
The SALT Collaborative Group:Lancet, 1991;338(8779):1345‐1349[BF‐0012]
15
Antiplatelet Trialists’Collaboration:Br. Med. J., 1994;308(6922):159‐168[BF‐0013]
16
草川三治ら:日本小児科学会雑誌,1983;87(12):2486‐2491[BF‐0014]
17
浅井利夫ら:小児科,1985;26(9):995‐1004[BF‐0015]
18
グッドマン・ギルマン薬理書,第9版,監訳:高折修二ら,1999;825‐882,1789‐1790,廣川書店[BF‐0226]
19
鶴見介登ら:炎症,1991;11(1):33‐42[BF‐0019]
20
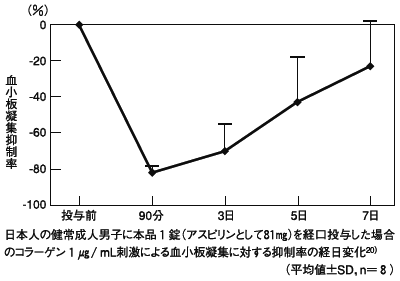
星 恵子ら:臨床薬理,2001;32(5):223‐230[BF‐0020]
21
Tohgi, H. et al.:Stroke, 1992;23(10):1400‐1403[BF‐0016]
22
谷口直樹ら:日本老年医学会誌,1981;18(6):463‐468[BF‐0017]
23
白幡 聡ら:日本小児科学会雑誌,1985;89(10):2207‐2214[BF‐0018]