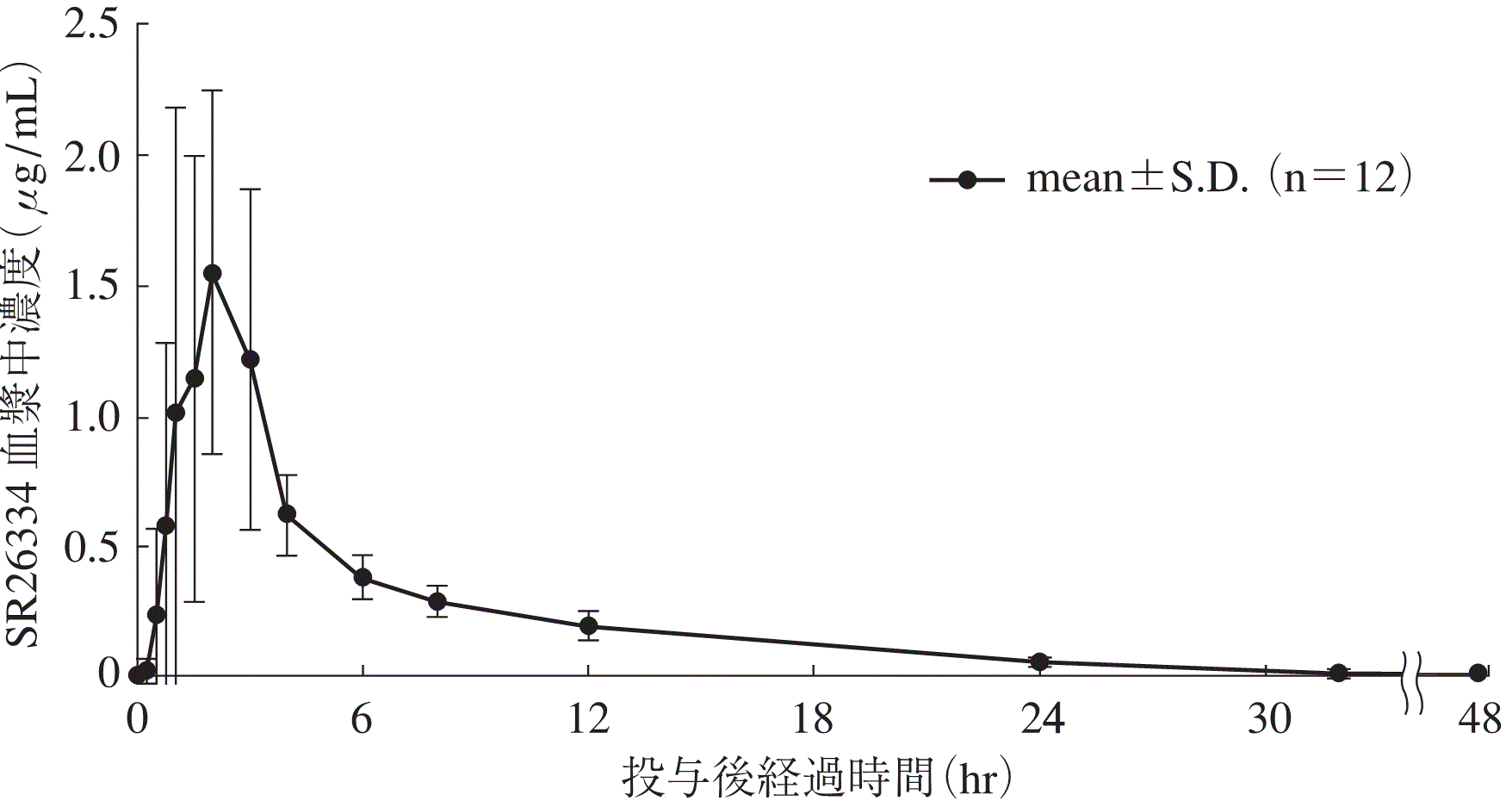
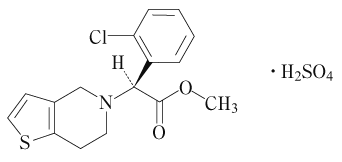
1
Diener H. C., et al.:Lancet. 2004;364(9431):331-337
2
Kobayashi M., et al.:J. Atheroscler. Thromb. 2015;22(11):1186-1196
3
Mega J. L., et al.:N. Engl. J. Med. 2009;360(4):354-362
4
Collet J. P., et al.:Lancet. 2009;373(9660):309-317
5
Sibbing D., et al.:Eur. Heart J. 2009;30(8):916-922
6
Giusti B., et al.:Am. J. Cardiol. 2009;103(6):806-811
7
Simon T., et al.:N. Engl. J. Med. 2009;360(4):363-375
8
Uchigata Y., et al.:Diabetes. 1995;44(10):1227-1232
9
Uchigata Y., et al.:Human Immunol. 2000;61:154-157
10
社内資料:生物学的同等性試験(2006年1月31日承認、CTD2.7.2.3)
11
社内資料:クロピドグレルの推定代謝経路(2006年1月31日承認、CTD2.6.4.6)
12
Savi P., et al.:Thromb. Haemost. 1994;72(2):313-317
13
Simon T., et al.:Clin. Pharmacol. Ther. 2011;90(2):287-295
14
Tornio A., et al.:Clin. Pharmacol. Ther. 2014;96(4):498-507
15
第十八改正日本薬局方解説書 廣川書店 2021;C1748- C1754
16
Deray G., et al.:Clin. Drug. Invest. 1998;16(4):319-328
17
Slugg P. H., et al.:J. Clin. Pharmacol. 2000;40(4):396-401
18
Furuta T., et al.:Pharmacogenomics. 2007;8(9):1199-1210
19
Fukuuchi Y., et al.:Cerebrovasc. Dis. 2008;25(1-2);40-49
20
Isshiki T., et al.:Int. Heart J. 2012;53(2):91-101
21
Shigematsu H., et al.:Ann. Vasc. Dis. 2012;5(3):364-375
22
Hollopeter G., et al.:Nature. 2001;409(6817):202-207
23
Savi P., et al.:Biochem. Biophys. Res. Commun. 2001;283(2):379-383
24
Holmsen H.:Eur. J. Clin. Invest. 1994;24(Suppl1):3-8
25
佐藤志樹 他:薬理と臨床. 2012;22(1):7-20
26
Umemura K., et al.:Thromb. Res. 1995;80(3):209-216
27
Yao S. K., et al.:Circ. Res. 1992;70(1):39-48
28
Herbert J. M., et al.:Thromb. Haemost. 1998;80(3):512-518