1
Bhatt, D. L. et al.:N. Engl. J. Med., 2019;380(1):11-22
2
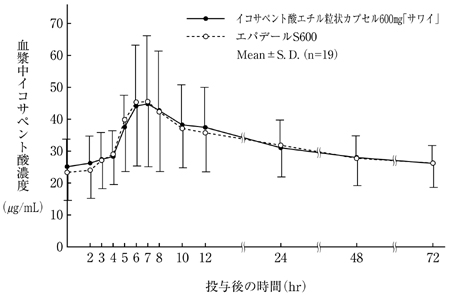
水山和之他:新薬と臨床, 2008;57(6):910-916
3
作用機序(エパデールEMカプセル:2022年6月20日承認、申請資料概要2.6.1)
4
Mizuguchi, K. et al.:Eur. J. Pharmacol., 1993;231(1):121-127
5
Mizuguchi, K. et al.:Eur. J. Pharmacol., 1993;235(2-3):221-227