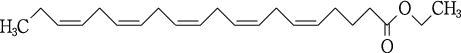
1
Bhatt, D. L. et al.:N. Engl. J. Med. 2019;380(1):11-22
2
村﨑かがり 他:Prog. Med. 2012;32(9):1941-1946
3
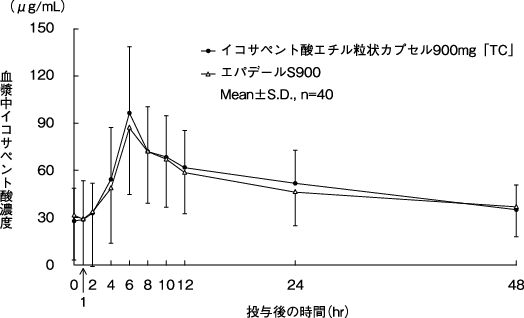
社内資料:生物学的同等性試験
4
石黒淳三 他:薬物動態 1987;2(6):683-702
5
秦 葭哉 他:臨牀と研究. 1998;75(10):2263-2278
6
齋藤 康 他:薬理と治療. 1998;26(12):2047-2062
7
Yokoyama, M. et al.:Lancet. 2007;369(9567):1090-1098
8
Mizuguchi, K. et al.:Eur. J. Pharmacol. 1993;231(1):121-127
9
Mizuguchi, K. et al.:Eur. J. Pharmacol. 1993;235(2-3):221-227
10
五島雄一郎 他:臨床医薬 1992;8(6):1293-1309
11
Sato, M. et al.:Biol. Pharm. Bull. 1993;16(4):362-367
12
Hamazaki, T. et al.:Prostaglandins. 1982;23(4):557-567
13
溝田雅洋 他:日本薬理学雑誌 1988;91(4):255-266
14
Sato, M. et al.:J. Cardiovasc. Pharmacol. 1993;22(1):1-9
15
Yamaguchi, K. et al.:Prostaglandins Leukotrienes Med. 1987;28(1):35-43
16
溝田雅洋 他:日本薬理学雑誌 1988;91(2):81-89
17
秦葭哉 他:老年医学 1992;30(5):819-852
18
秦葭哉 他:老年医学 1992;30(5):799-818
19
高久史麿 他:臨床医薬 1991;7(11):2567-2589
20
田村泰 他:臨床医薬 1991;7(8):1817-1834
21
松沢佑次 他:臨床医薬 1991;7(8):1801-1816
22
都島基夫 他:臨床医薬 1991;7(8):1783-1799
23
Mizuguchi, K. et al.:Jpn. J. Pharmacol. 1992;59(3):307-312
24
水口清 他:動脈硬化 1990;18(5):471
25
矢野崇 他:動脈硬化 1990;18(5):535
26
水口清 他:動脈硬化 1990;18(5):536





 37
37