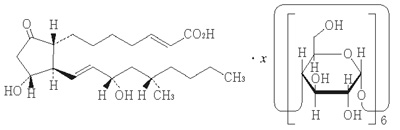
1
穐本晃他:現代医療, 1988;20:817-820
2
宮本茂敏他:現代医療, 1986;18(増Ⅱ):56-69
3
山本智英他:薬理と治療, 1981;9:1463-1476
4
第十八改正日本薬局方解説書, 廣川書店, 2021;C-6131-6136
5
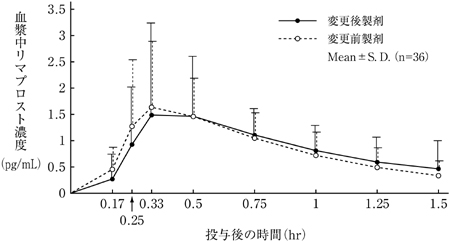
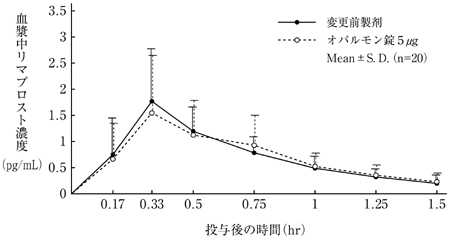
社内資料:生物学的同等性試験(処方変更時)
6
社内資料:生物学的同等性試験
7
宮本茂敏他:現代医療, 1986;18(増Ⅱ):80-103
8
チトクロームP450に対するリマプロスト アルファデクスの阻害作用(オパルモン錠/プロレナール錠:2001年4月4日承認、申請資料概要ヘ.1.(1))
9
草場昭他:医学のあゆみ, 1986;138:217-226
10
栗原章他:臨床医薬, 1996;12:511-529
11
〈腰部脊柱管狭窄症〉臨床成績集計①(オパルモン錠/プロレナール錠:2001年4月4日承認、申請資料概要ト.1)
12
〈腰部脊柱管狭窄症〉臨床成績集計②(オパルモン錠/プロレナール錠:2009年12月21日公表、再審査報告書)
13
北川敏一他:現代医療, 1986;18(増Ⅱ):1-11
14
北川敏一他:現代医療, 1986;18(増Ⅱ):12-20
15
木谷泰治他:現代医療, 1988;20:810-816
16
前田義春他:血液と脈管, 1982;13:142-145
17
Tsuboi, T. et al.:Arch. Intern. Pharmacodyn. Ther., 1980;247:89-102
18
Tsuboi, T. et al.:Thrombosis Res., 1980;20:573-580
19
Fujitani, B. et al.:Jpn. J. Pharmacol., 1986;40:31-35
20
伊藤邦臣他:基礎と臨床, 1995;29:2577-2585
21
竹信敬史他:基礎と臨床, 1996;30:221-227
22
椹木博之他:基礎と臨床, 1996;30:237-244
23
鹿山悟他:基礎と臨床, 1996;30:229-236
24
藤谷武一他:基礎と臨床, 1996;30:245-250