1
社内資料:生物学的同等性試験
2
Ashida,S.et al.:Thromb.Haemost.1979;41(2):436-449
3
Ashida,S.et al.:Thromb.Haemost.1978;40(3):542-550
4
Harker,L.A.et al.:J.Clin.Invest.1969;48(6):963-974
抗血小板剤
1錠 5.9円
有効成分 | 1錠中 |
|---|---|
有効成分 | 日局 チクロピジン塩酸塩… 100mg |
添加剤 | 乳糖水和物、トウモロコシデンプン、ヒドロキシプロピルセルロース、カルメロース、硬化油、ショ糖脂肪酸エステル、ヒプロメロース、マクロゴール6000、タルク、酸化チタン |
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 白色~微黄色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 8.2mm 大きさ(厚さ) 3.7mm |
| 質量 | 205mg |
| 識別コード | Tw/PT(表/裏) Tw.PT |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
バルビツール酸誘導体 テオフィリン チザニジン塩酸塩 | これらの薬剤の作用を増強することがある。 | 本剤がこれらの薬剤の肝臓での代謝を阻害して、血中濃度を上昇させると考えられている。 |
フェニトイン | フェニトイン中毒症状(運動失調等)があらわれるおそれがある。 | 本剤がフェニトインの血中濃度を上昇させるとの報告がある。 |
抗凝固薬 ワルファリン等 血小板凝集抑制作用を有する薬剤 アスピリン等 血栓溶解薬 ウロキナーゼ アルテプラーゼ等 | 出血傾向が増強することがある。 | 相互に作用を増強すると考えられている。 |
シクロスポリン | シクロスポリンの作用が減弱することがある。 | 本剤がシクロスポリンの血中濃度を低下させるとの報告がある。 |
選択的セロトニン再取り込み阻害剤(SSRI) フルボキサミンマレイン酸塩 塩酸セルトラリン等 | 出血を助長するおそれがある。 | SSRIの投与により血小板凝集が阻害され、本剤との併用により出血を助長すると考えられる。 |
0.1~5%未満 | 0.1%未満 | 頻度不明注) | |
|---|---|---|---|
血液 | 白血球減少、貧血、顆粒球減少 | 好酸球増多 | |
過敏症 | 発疹、そう痒感、じん麻疹、発熱等 | 発赤、紅斑、浮腫等 | |
肝臓 | AST上昇、ALT上昇、γ-GTP上昇、Al-P上昇、黄疸等 | LDH上昇、ビリルビン上昇、総コレステロール上昇等 | |
腎臓 | クレアチニン上昇、BUN上昇等 | ||
消化器 | 悪心、嘔吐、嘔気、食欲不振、胃不快感、下痢 | 口内炎、腹痛 | 味覚障害、膵酵素上昇 |
その他 | 頭痛、鼻出血、皮下出血、歯肉出血 | めまい、易疲労感、心悸亢進、全身倦怠感、血尿 | 眼底出血、結膜出血 |
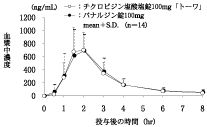
製剤投与量 (チクロピジン 塩酸塩として) | 判定パラメータ | 参考パラメータ | |||
AUC0-8 (ng・hr/mL) | Cmax (ng/mL) | tmax (hr) | t1/2 (hr) | ||
チクロピジン塩酸塩錠 100mg「トーワ」 | 3錠 (300mg) | 1810±741 | 773.2±291.8 | 1.86±0.41 | 2.10±0.64 |
パナルジン錠100mg | 3錠 (300mg) | 1849±815 | 789.3±337.7 | 1.82±0.25 | 2.40±0.89 |
 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379