1
Lagrange F, et al.:Thromb Haemost. 2002;87:831-835
2
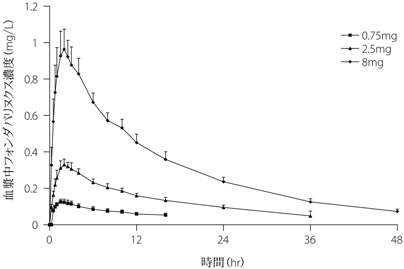
社内資料:薬物動態試験(2007年4月18日承認(1.5mg、2.5mg製剤)、CTD2.7.2.3.1)
3
社内資料:薬物動態試験(2011年1月21日承認、CTD2.7.2.3)
4
Paolucci F, et al.:Clin Pharmacokinet. 2002;41:11-18
5
Lieu C, et al.:Clin Pharmacokinet. 2002;41:19-26
6
社内資料:急性肺血栓塞栓症患者を対象とした第Ⅲ相臨床試験(2011年1月21日承認、CTD2.7.6)
7
社内資料:急性深部静脈血栓症患者を対象とした第Ⅲ相臨床試験(2011年1月21日承認、CTD2.7.6)
8
Olson ST, et al.:J Biol Chem. 1992;267:12528-12538
9
社内資料:静脈血栓症モデルに対する効果(2007年4月18日承認(1.5mg、2.5mg製剤)、CTD2.6.2.2)
10
社内資料:止血に及ぼす影響(2007年4月18日承認(1.5mg、2.5mg製剤)、CTD2.6.2.3)
11
社内資料:PF4との結合親和性及びHIT抗体に対する交差反応性(2007年4月18日承認(1.5mg、2.5mg製剤)、CTD2.6.2.3)
12
社内資料:臨床薬力学試験(2007年4月18日承認(1.5mg、2.5mg製剤)、CTD2.7.2.3.2)