1
社内資料:マウスを用いた生殖発生毒性試験(2012年12月25日承認、CTD 2.6.6.6)
2
社内資料:妊娠ラットを用いた組織分布試験(2012年12月25日承認、CTD 2.6.4.4)
3
社内資料:ラットを用いた生殖発生毒性試験(2012年12月25日承認、CTD 2.6.6.6)
4
社内資料:ウサギを用いた生殖発生毒性試験(2012年12月25日承認、CTD 2.6.6.6)
5
社内資料:授乳ラットを用いた組織分布試験(2012年12月25日承認、CTD 2.6.4.4)
6
Brodsky S, et al.:J Am Soc Nephrol. 2018;29:2787-2793
7
Zakrocka I, et al.:Adv Clin Exp Med. 2022;31:165-173
8
社内資料:外国人健康成人被験者における活性炭投与試験(2012年12月25日承認、CTD 2.7.6)
9
Alexander JH, et al.:N Engl J Med. 2011;365(8):699-708
10
Pengo V, et al.:Blood. 2018;132:1365-1371
11
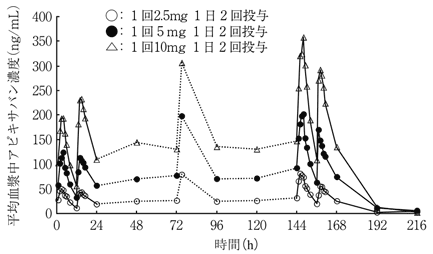
社内資料:日本人及び外国人健康成人被験者における単回投与試験(2012年12月25日承認、CTD 2.7.6)
12
Yamahira N, et al.:Int J Clin Pharmacol Ther. 2014;52(7):564-573
13
Song Y, et al.:Clin Ther. 2016:38(7):1674-1685
14
社内資料:アピキサバン静脈内投与を含むリファンピシンとの相互作用(2012年12月25日承認、CTD 2.7.2.2)
15
社内資料:静脈内投与試験(2012年12月25日承認、CTD 2.7.2.2)
16
社内資料:マスバランス試験(2012年12月25日承認、CTD 2.7.2.2)
17
社内資料:ヒトでの蛋白結合率(2012年12月25日承認、CTD 2.6.4.4)
18
社内資料:ヒトでの代謝(2012年12月25日承認、CTD 2.6.4.5)
19
社内資料:代謝に関与する酵素の検討(2012年12月25日承認、CTD 2.6.4.5)
20
社内資料:ヒトでの排泄(2012年12月25日承認、CTD 2.6.4.6)
21
社内資料:膜透過性(in vitro)(2012年12月25日承認、CTD 2.6.4.3)
22
Chang M, et al.: J Clin Pharmacol. 2016;56(5):637-645
23
Wang X, et al.:J Clin Pharmacol. 2016;56(5):628-636
24
社内資料:肝機能の影響試験(2012年12月25日承認、CTD2.7.2.2)
25
Frost CE, et al.:Clin Pharmacokinet. 2015;54(6):651-662
26
Upreti VV, et al.:Br J Clin Pharmacol. 2013;76(6):908-916
27
Frost CE, et al.:Br J Clin Pharmacol. 2015;79(5):838-846
28
Frost C, et al.:Br J Clin Pharmacol. 2014;78(4):877-885
29
Vakkalagadda B, et al.:Am J Cardiovasc Drugs. 2016;16:119-127
30
Barrett YC, et al.:Thromb Haemost. 2012;107(5):916-924
31
Frost C, et al.:J Clin Pharmacol. 2015;55(5):549-555
32
社内資料:非弁膜症性心房細動患者におけるワルファリンを対照とした国際共同第3相試験(ARISTOTLE試験)(2012年12月25日承認、CTD2.7.6)
33
Granger CB, et al.:N Engl J Med. 2011;365(11):981-992
34
Ogawa S, et al.:Circ J. 2011;75(8):1852-1859
35
Nakamura M, et al.:Circ J. 2015;79(6) :1230-1236
36
Agnelli G, et al.:N Engl J Med. 2013;369(9):799-808
37
社内資料:トロンビン産生に対する作用(2012年12月25日承認、CTD 2.6.2.2)
38
社内資料:血液凝固に対する作用(2012年12月25日承認、CTD2.6.2.2)
39
社内資料:血小板凝集に対する作用(2012年12月25日承認、CTD2.6.2.2)
40
社内資料:血栓及び出血モデルラットにおける作用(2012年12月25日承認、CTD2.6.2.2)
41
社内資料:血栓及び出血モデルウサギにおける作用(2012年12月25日承認、CTD2.6.2.2)
42
社内資料:血栓及び出血モデルイヌにおける作用(2012年12月25日承認、CTD2.6.2.2)