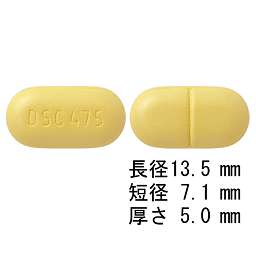
1
Brodsky S, et al.:J Am Soc Nephrol. 2018;29(12):2787-2793
2
Zakrocka I, et al.:Adv Clin Exp Med. 2022;31(2):165-173
3
社内資料:血液透析患者における薬物動態(2014年9月26日承認、CTD2.7.6.3)
4
Pengo V, et al.:Blood 2018;132(13):1365-1371
5
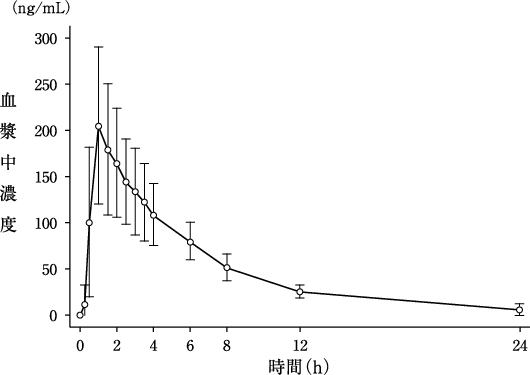
社内資料:健康成人男性を対象とした単回投与試験(2011年4月22日承認、CTD2.7.6.1)
6
社内資料:健康成人男性を対象とした反復投与試験(2011年4月22日承認、CTD2.7.6.5)
7
社内資料:腎機能障害患者における薬物動態(2011年4月22日承認、CTD2.7.6.10)
8
社内資料:高度腎機能障害を有する非弁膜症性心房細動患者を対象とした第Ⅲ相試験成績(2014年9月26日承認、CTD2.7.6.15)
9
社内資料:肝機能障害患者における薬物動態(2011年4月22日承認、CTD2.7.6.38)
10
社内資料:心房細動患者を対象とした第Ⅲ相国際共同試験成績(ENGAGE AF-TIMI 48)(2014年9月26日承認、CTD2.7.6.11)
11
社内資料:出血リスクが高い高齢心房細動患者を対象とした第Ⅲ相試験成績(ELDERCARE-AF)
12
社内資料:急性症候性静脈血栓塞栓症患者を対象とした第Ⅲ相国際共同試験成績(Hokusai-VTE)(2014年9月26日承認、CTD2.7.6.16)
13
社内資料:人工膝関節全置換術施行患者における第Ⅲ相試験成績(2011年4月22日承認、CTD2.7.6.26)
14
社内資料:人工股関節全置換術施行患者における第Ⅲ相試験成績(2011年4月22日承認、CTD2.7.6.27)
15
社内資料:股関節骨折手術施行患者における第Ⅲ相試験成績(2011年4月22日承認、CTD2.7.6.30)
16
社内資料:エドキサバンのXa酵素阻害作用(2011年4月22日承認、CTD2.6.2.2)
17
社内資料:ラット各種血栓モデルにおける抗血栓作用(2011年4月22日承認、CTD2.6.2.2)
18
社内資料:出血時間に及ぼす影響(2011年4月22日承認、CTD2.6.2.3)
19
社内資料:血液凝固因子製剤による抗凝固活性のリバース(2011年4月22日承認、CTD2.6.2.3)