添付文書番号
3334402G1064_1_13
企業コード
180079
作成又は改訂年月
日本標準商品分類番号
873334
薬効分類名
血液凝固阻止剤 ヘパリンロック液
承認等
販売名
ヘパリンNaロック用10単位/mLシリンジ「オーツカ」5mL
販売名コード
販売名英字表記
Heparin Na LOCK SYRINGES
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
販売名
ヘパリンNaロック用10単位/mLシリンジ「オーツカ」10mL
販売名コード
販売名英字表記
Heparin Na LOCK SYRINGES
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
販売名
ヘパリンNaロック用100単位/mLシリンジ「オーツカ」5mL
販売名コード
販売名英字表記
Heparin Na LOCK SYRINGES
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
販売名
ヘパリンNaロック用100単位/mLシリンジ「オーツカ」10mL
販売名コード
販売名英字表記
Heparin Na LOCK SYRINGES
承認番号等
販売開始年月
貯法、有効期間
基準名
規制区分
一般的名称
ヘパリンナトリウム
組成・性状
組成
ヘパリンNaロック用10単位/mLシリンジ「オーツカ」5mL
有効成分 | 1シリンジ5mL中
ヘパリンナトリウム 50単位 |
|---|
添加剤 | 塩化ナトリウム 45.0mg クエン酸ナトリウム水和物 1.47mg 水酸化ナトリウム 適量 |
|---|
| 備考 | ヘパリンナトリウムは、健康なブタの腸粘膜由来 |
|---|
ヘパリンNaロック用10単位/mLシリンジ「オーツカ」10mL
有効成分 | 1シリンジ10mL中
ヘパリンナトリウム 100単位 |
|---|
添加剤 | 塩化ナトリウム 90.0mg クエン酸ナトリウム水和物 2.94mg 水酸化ナトリウム 適量 |
|---|
| 備考 | ヘパリンナトリウムは、健康なブタの腸粘膜由来 |
|---|
ヘパリンNaロック用100単位/mLシリンジ「オーツカ」5mL
有効成分 | 1シリンジ5mL中
ヘパリンナトリウム 500単位 |
|---|
添加剤 | 塩化ナトリウム 45.0mg クエン酸ナトリウム水和物 1.47mg 水酸化ナトリウム 適量 |
|---|
| 備考 | ヘパリンナトリウムは、健康なブタの腸粘膜由来 |
|---|
ヘパリンNaロック用100単位/mLシリンジ「オーツカ」10mL
有効成分 | 1シリンジ10mL中
ヘパリンナトリウム 1000単位 |
|---|
添加剤 | 塩化ナトリウム 90.0mg クエン酸ナトリウム水和物 2.94mg 水酸化ナトリウム 適量 |
|---|
| 備考 | ヘパリンナトリウムは、健康なブタの腸粘膜由来 |
|---|
製剤の性状
ヘパリンNaロック用10単位/mLシリンジ「オーツカ」5mL
| pH | 5.5~8.0 |
|---|
| 浸透圧比 | (生理食塩液に対する比)約1 |
|---|
| 性状 | 無色~淡黄色澄明の液 |
|---|
ヘパリンNaロック用10単位/mLシリンジ「オーツカ」10mL
| pH | 5.5~8.0 |
|---|
| 浸透圧比 | (生理食塩液に対する比)約1 |
|---|
| 性状 | 無色~淡黄色澄明の液 |
|---|
ヘパリンNaロック用100単位/mLシリンジ「オーツカ」5mL
| pH | 5.5~8.0 |
|---|
| 浸透圧比 | (生理食塩液に対する比)約1 |
|---|
| 性状 | 無色~淡黄色澄明の液 |
|---|
ヘパリンNaロック用100単位/mLシリンジ「オーツカ」10mL
| pH | 5.5~8.0 |
|---|
| 浸透圧比 | (生理食塩液に対する比)約1 |
|---|
| 性状 | 無色~淡黄色澄明の液 |
|---|
効能又は効果
用法及び用量
静脈内留置ルート内を充填するのに十分な量を注入する。
用法及び用量に関連する注意
10単位/mL製剤は通常6時間までの、100単位/mL製剤は12時間までを標準とし最長24時間までの静脈内留置ルート内の血液凝固防止(ヘパリンロック)に用いる。
重要な基本的注意
血液凝固能検査等、出血管理を十分行いつつ使用すること。
本剤の抗凝固作用を急速に中和する必要がある場合にはプロタミン硫酸塩を投与すること。
ヘパリン起因性血小板減少症(HIT:heparin-induced thrombocytopenia)があらわれることがあるので、本剤投与後は血小板数を測定すること。
特定の背景を有する患者に関する注意
合併症・既往歴等のある患者
出血している患者
血小板減少性紫斑病、血管障害による出血傾向、血友病その他の血液凝固障害(汎発性血管内血液凝固症候群(DIC)を除く)、月経期間中、手術時、消化管潰瘍、尿路出血、喀血、流早産・分娩直後等性器出血を伴う妊産褥婦、頭蓋内出血の疑いのある患者等には、治療上やむを得ないと判断される場合を除き、投与しないこと。出血を助長することがあり、ときには致命的になるおそれがある。
出血する可能性のある患者
内臓腫瘍、消化管の憩室炎、大腸炎、亜急性細菌性心内膜炎、重症高血圧症、重症糖尿病の患者等には、治療上やむを得ないと判断される場合を除き、投与しないこと。血管や内臓の障害箇所に出血が起こるおそれがある。
中枢神経系の手術又は外傷後日の浅い患者
治療上やむを得ないと判断される場合を除き、投与しないこと。出血を助長することがあり、ときには致命的になるおそれがある。
本剤の成分に対し過敏症の既往歴のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。
ヘパリン起因性血小板減少症(HIT:heparin-induced thrombocytopenia)の既往歴のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。投与が必要な場合は、本剤投与後は血小板数を測定すること。HITがあらわれることがある。
腎機能障害患者
重篤な腎障害のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。排泄が障害され、本剤の作用が持続するおそれがある。
肝機能障害患者
重篤な肝障害のある患者
治療上やむを得ないと判断される場合を除き、投与しないこと。凝固因子やアンチトロンビンⅢの産生が低下していることがあるので、本剤の作用が変動(増強又は減弱)するおそれがある。
妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
高齢者
相互作用
併用注意(併用に注意すること)
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|
抗凝固剤 | 本剤の作用が出血傾向を増強するおそれがある。 | 本剤の抗凝固作用と血液凝固因子の生合成阻害作用により相加的に出血傾向が増強される。 |
血栓溶解剤 ウロキナーゼ
t-PA製剤 等 | 本剤の作用が出血傾向を増強するおそれがある。 | 本剤の抗凝固作用とフィブリン溶解作用により相加的に出血傾向が増強される。 |
血小板凝集抑制作用を有する薬剤 アスピリン
ジピリダモール
チクロピジン塩酸塩 等 | 本剤の作用が出血傾向を増強するおそれがある。 | 本剤の抗凝固作用と血小板凝集抑制作用により相加的に出血傾向が増強される。 |
テトラサイクリン系抗生物質
強心配糖体 ジギタリス製剤 ニトログリセリン製剤 | 本剤の作用が減弱するおそれがある。 | 機序は不明である。 |
筋弛緩回復剤 スガマデクスナトリウム | 本剤の抗凝固作用が増強されるおそれがあるので、患者の状態を観察するとともに血液凝固に関する検査値に注意すること。 | 作用機序は不明であるが、スガマデクスナトリウム4mg/kgと抗凝固剤の併用中に活性化部分トロンボプラスチン時間(APTT)又はプロトロンビン時間(PT)の軽度で一過性の延長が認められている。 |
副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
重大な副作用
ショック(頻度不明)、アナフィラキシー(頻度不明)
血圧低下、意識低下、呼吸困難、チアノーゼ、蕁麻疹等の異常が認められた場合には投与を中止し、適切な処置を行うこと。
血小板減少(頻度不明)、HIT等に伴う血小板減少・血栓症(頻度不明)
著明な血小板減少があらわれることがある。HITはヘパリン-血小板第4因子複合体に対する自己抗体(HIT抗体)の出現による免疫学的機序を介した病態であり、著明な血小板減少と脳梗塞、肺塞栓症、深部静脈血栓症等の血栓症やシャント閉塞、回路内閉塞等を伴う。また、投与終了数週間後に、HITが遅延して発現したとの報告もある。血小板数の著明な減少や血栓症を疑わせる異常が認められた場合には投与を中止し、適切な処置を行うこと。
出血(頻度不明)
抗凝固療法で1000単位/mLのヘパリンナトリウム注射液を投与した場合では、脳出血、消化管出血、肺出血、硬膜外血腫、後腹膜血腫、腹腔内出血、術後出血、刺入部出血等、重篤な出血があらわれることがある。
その他の副作用
〈本剤を静脈内留置ルート内の血液凝固の防止に用いた場合〉
| 0.1~5%未満 |
|---|
注射部位 | 血管痛 |
|---|
肝臓 | ALT上昇、総ビリルビン上昇 |
|---|
その他 | PT低下・延長、APTT延長、フィブリノーゲン上昇 |
|---|
〈抗凝固療法で1000単位/mLのヘパリンナトリウム注射液を投与した場合〉
| 頻度不明 |
|---|
過敏症 | そう痒感、蕁麻疹、悪寒、発熱、鼻炎、気管支喘息、流涙等 |
|---|
皮膚 | 脱毛、白斑、出血性壊死等 |
|---|
肝臓 | AST、ALTの上昇等 |
|---|
長期投与 | 骨粗鬆症、低アルドステロン症 |
|---|
臨床検査結果に及ぼす影響
ヘパリンは血液検査結果に影響を及ぼす可能性があるので、留置している同一ルート又は近傍からの採血を避けること。
適用上の注意
全般的な注意
使用時には、以下の点に注意すること。
感染に対する配慮をすること。
シリンジが破損するおそれがあるので、シリンジを鉗子等で叩くなど、強い衝撃を与えないこと。特に低温下ではシリンジが破損しやすいので注意すること。
押子(プランジャー)が外れたり、ガスケットが変形し薬液が漏出したりするおそれがあるので押子のみを持たないこと。
押子を反時計回りに回転させると接続に緩みが生じ、ガスケットから押子が外れるおそれがあるので、押子を反時計回りに回転させないこと。
薬剤投与時の注意
使用に際しては、ブリスター包装を開封口からゆっくり開け、外筒(バレル)を持って取り出すこと。
押子の緩みがないか確認すること。緩みが認められた場合は、押子を時計回りに回転させ締め直すこと。
筒先のキャップをゆっくり回転させながら外して、静脈内留置ルートに確実に接続すること。キャップを外した後は、筒先に触れないこと。
治療薬剤とヘパリンが配合不適の場合があるので、静脈内留置ルート内を生理食塩液で十分フラッシングした後、本剤を注入しロックすること。
薬剤投与後の注意
開封後の使用は1回限りとし、使用後の残液はシリンジとともに速やかに廃棄すること。
その他の注意
臨床使用に基づく情報
HIT発現時に出現するHIT抗体は100日程度で消失~低下するとの報告がある。
臨床成績
有効性及び安全性に関する試験
国内第Ⅲ相試験
中心静脈又は末梢静脈に血管カテーテルを留置している患者を対象に実施した臨床試験における有効率(非閉塞率)は、10単位/mL製剤(6時間までのヘパリンロック)で96.5%(55例/57例)、100単位/mL製剤(24時間までのヘパリンロック)で93.4%(57例/61例)、全体で94.9%(112例/118例)であった。
安全性が評価された122例中臨床検査値異常変動を除く副作用(自他覚症状)は血管痛が1例(1%)報告されている。また、122例中臨床検査値異常変動(発現例数/測定例数)は、プロトロンビン(PT)低下・延長2%(2/117)、総ビリルビン上昇1%(1/117)、活性化部分トロンボプラスチン(APTT)延長1%(1/117)、フィブリノーゲン上昇1%(1/117)、ALT上昇1%(1/119)であった。
薬効薬理
作用機序
血液凝固系には第Ⅰから第ⅩⅢまでの血液凝固因子やプレカリクレイン、高分子キニノーゲンなどが働いているが、多くの因子がこれらを調節している。これらの調節因子のうち、アンチトロンビンⅢ(ATⅢ)がヘパリンにより活性化され、トロンビンをはじめ第Ⅸa~Ⅻa因子及びカリクレインを阻害することによって、血液凝固を抑制する。
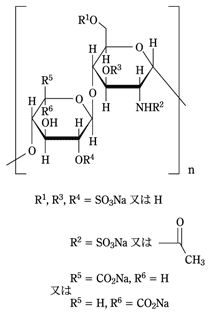
有効成分に関する理化学的知見
一般的名称
ヘパリンナトリウム(Heparin Sodium)
性状
白色~帯灰褐色の粉末又は粒で、においはない。
水にやや溶けやすく、エタノール(95)又はジエチルエーテルにほとんど溶けない。
吸湿性である。
化学構造式
取扱い上の注意
ブリスター包装内は滅菌しているので、使用時まで開封しないこと。
以下の場合には使用しないこと。
ブリスター包装が破損している場合
シリンジから薬液が漏れている場合
性状その他薬液に異状が認められる場合
シリンジに破損等の異状が認められる場合
キャップが外れている場合
包装
〈ヘパリンNaロック用10単位/mLシリンジ「オーツカ」5mL〉
5mL×10シリンジ(ルアースリップタイプ)
5mL×50シリンジ(ルアースリップタイプ)
5mL×10シリンジ(ルアーロックタイプ)
〈ヘパリンNaロック用10単位/mLシリンジ「オーツカ」10mL〉
10mL×10シリンジ(ルアースリップタイプ)
10mL×50シリンジ(ルアースリップタイプ)
10mL×10シリンジ(ルアーロックタイプ)
〈ヘパリンNaロック用100単位/mLシリンジ「オーツカ」5mL〉
5mL×10シリンジ(ルアースリップタイプ)
5mL×50シリンジ(ルアースリップタイプ)
5mL×10シリンジ(ルアーロックタイプ)
〈ヘパリンNaロック用100単位/mLシリンジ「オーツカ」10mL〉
10mL×10シリンジ(ルアースリップタイプ)
10mL×50シリンジ(ルアースリップタイプ)
10mL×10シリンジ(ルアーロックタイプ)
主要文献
1
片山寛次ほか:輸液・栄養ジャーナル.2002;24(7):381-390
2
第十八改正日本薬局方解説書:廣川書店.2021;C-5257-5260
文献請求先及び問い合わせ先
製造販売業者等
株式会社大塚製薬工場
徳島県鳴門市撫養町立岩字芥原115