1
角尾道夫, 他. 臨牀透析. 1999;15(8):1193-217.
2
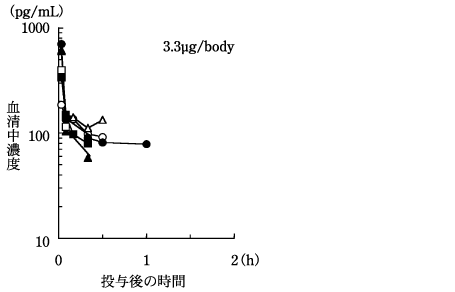
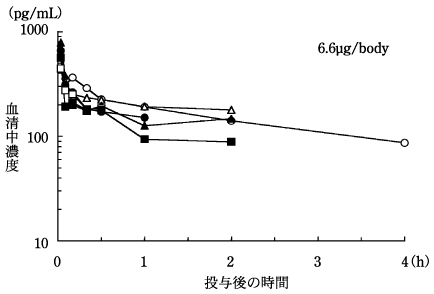
二次性副甲状腺機能亢進症患者における薬物動態(2000年7月3日承認、申請資料概要 へ.3(1)3))
3
社内資料:薬物動態試験(ヒト血漿蛋白結合率、in vitro)
4
社内資料:薬物動態試験(胎盤、胎児移行性)
5
社内資料:薬物動態試験(乳汁移行性)
6
社内資料:薬物動態試験(代謝酵素阻害、in vitro)
7
後期第II相二重盲検比較試験(2000年7月3日承認、申請資料概要 ト.4(3))
8
第III相二重盲検比較試験(2000年7月3日承認、申請資料概要 ト.4(4))
9
黒川清, 他. 腎と透析. 2000;48(6):875-97.
10
Tsukamoto, Y, et al. Am. J Kidney Dis. 2000;35(3):458-64.
11
栗原怜, 他. 腎と透析. 1999;47(4):559-72.
12
福澤良彦, 他. 透析会誌. 1993;26(10):1585-91.
13
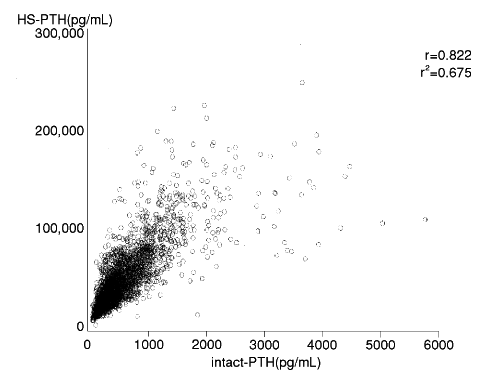
血清中intact-PTHとHS-PTHの相関(2000年7月3日承認、申請資料概要 ト.5(1)2))
14
Brown, AJ, et al. J Clin Invest. 1989;84(3):728-32.
15
Ichikawa, F, et al. Nephrology. 1998;4(5-6):391-5.
16
薬理作用試験(骨芽細胞に対する作用、in vitro)(2000年7月3日承認、申請資料概要 ホ.2-(7))
17
Sato, K, et al. Nephrology. 1998;4(3):177-82.
18
薬理作用試験(腎不全ラットにおけるPTH低下作用)(2000年7月3日承認、申請資料概要 ホ.1-(2)-1))
19
薬理作用試験(腎不全イヌにおけるPTH低下作用)(2000年7月3日承認、申請資料概要 ホ.1-(2)-3))
20
Hirata, M, et al. Kidney Int. 1999;56(6):2040-7.
21
Monier-Faugere, M-C, et al. Kidney Int. 1999;55(3):821-32.