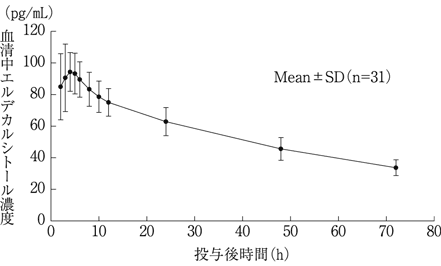
1
製剤間のBE試験(ED-112JP)(2011年1月21日承認、CTD 2.7.1.2.4)
2
薬物相互作用試験(ED-111JP)(2011年1月21日承認、CTD 2.7.2.2.2.7)
3
第Ⅰ相反復投与試験(ED-71T-103)(2011年1月21日承認、CTD 2.7.2.2.2.2)
4
後期第Ⅱ相試験(ED007JP)(2011年1月21日承認、CTD 2.7.2.2.2.4)
5
統合母集団薬物動態解析(2011年1月21日承認、CTD 2.7.2.2.2.9)
6
血漿(血清)蛋白結合性(in vitro)(2011年1月21日承認、CTD 2.6.4.4.4)
7
血漿(血清)蛋白結合の性差(2011年1月21日承認、CTD 2.6.4.4.5)
8
in vivo代謝(ラット)(2011年1月21日承認、CTD 2.6.4.5.3)
9
in vitro代謝(2011年1月21日承認、CTD 2.6.4.5.2)
10
代謝関与酵素(2011年1月21日承認、CTD 2.6.4.5.4)
11
尿・糞中排泄(2011年1月21日承認、CTD 2.6.4.6.1)
12
肝機能障害患者での薬物動態試験(ED-301JP)(2011年1月21日承認、CTD 2.7.2.2.2.8)
13
第Ⅲ相試験(ED-209JP)(2011年1月21日承認、CTD 2.5.4.3, 2.7.4.2.1及び2.7.6.14)
14
反復投与でのBA試験(ED006JP)(2011年1月21日承認、CTD 2.7.1.2.3)
15
臨床薬理試験(ED008JP)(2011年1月21日承認、CTD 2.7.2.2.2.5)
16
反復投与時の薬物動態(2011年1月21日承認、CTD 2.7.2.3.2.2)
17
薬物代謝酵素誘導能(2011年1月21日承認、CTD 2.6.4.5.5)
18
CYP酵素に対する阻害作用(2011年1月21日承認、CTD 2.6.4.5.6)
19
薬理試験〈破骨細胞形成抑制活性(in vitro)〉(2011年1月21日承認、CTD 2.6.2.2.1.3)
20
薬理試験〈腸管からのカルシウム吸収促進作用(ラット)〉(2011年1月21日承認、CTD 2.6.2.2.1.4)
21
薬理試験〈血中カルシウム濃度及び尿中カルシウム排泄量に及ぼす影響(ラット)〉(2011年1月21日承認、CTD 2.6.2.2.1.5)
22
薬理試験〈抗クル病作用(ラット)〉(2011年1月21日承認、CTD 2.6.2.2.1.6)
23
薬理試験〈骨粗鬆症モデリング動物(OVXラット)の骨量減少に対する効果〉(2011年1月21日承認、CTD 2.6.2.2.4)
24
薬理試験〈骨粗鬆症リモデリング動物(OVXサル)の骨量減少に対する効果〉(2011年1月21日承認、CTD 2.6.2.2.5)
25
薬理試験〈骨折モデルラットの骨折治癒過程に及ぼす影響〉(2011年1月21日承認、CTD 2.6.2.2.6)





 (球形)
(球形) (球形)
(球形)