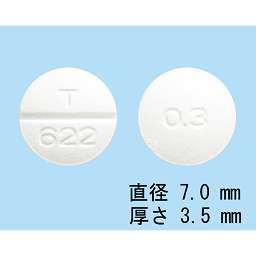
1
揖場和子:透析と腎性骨異栄養症. 中外医学社. 1994 ; 176-192
2
井上聖士ほか:透析患者の骨病変―その見方と考え方―. 日本メディカルセンター. 1988 ; 249-258
3
Velentzas C, et al. : Can Med Assoc J. 1978 ; 118 (1) : 45-50
4
角尾道夫:臨床医薬. 1997 ; 13 (8) : 1907-1919
5
健常人における食事の影響(承認年月日:2001.04.04、申請資料概要ヘ3.(2).2))
6
赤尾恭子ほか:基礎と臨床. 1996 ; 30 (11) : 2945-2953
7
小室勢津子ほか:薬物動態. 1996 ; 11 (5) : 505-517
8
小室勢津子ほか:基礎と臨床. 1996 ; 30 (11) : 2915-2932
9
各種動物における血清中濃度推移(承認年月日:2001.04.04、申請資料概要ヘ2.(2).2))
10
各種動物における組織中代謝物(承認年月日:2001.04.04、申請資料概要ヘ2.(6).3))
11
小室勢津子ほか:薬物動態. 1996 ; 11 (5) : 530-540
12
小室勢津子ほか:薬物動態. 1996 ; 11 (5) : 518-529
13
浅野泰ほか:臨床医薬. 1997 ; 13 (10) : 2559-2571
14
森井浩世ほか:腎と透析. 1997 ; 42 (5) : 697-721
15
森井浩世ほか:日本透析医学会誌. 1997 ; 30 (6) : 895-910
16
森井浩世ほか:腎と透析. 1997 ; 43 (2) : 271-283
17
森井浩世ほか:J Bone Miner Metab. 1998 ; 16 (1) : 34-43
18
森井浩世ほか:J Bone Miner Metab. 1998 ; 16 (1) : 44-54
19
松本俊夫ほか:ホルモンと臨床. 1997 ; 45 (6) : 595-608
20
松本俊夫ほか:ホルモンと臨床. 1997 ; 45 (7) : 693-706
21
松本俊夫ほか:ホルモンと臨床. 1997 ; 45 (8) : 789-803
22
吉川靖三ほか:診療と新薬. 1997 ; 34 (4) : 331-357
23
吉川靖三ほか:診療と新薬. 1997 ; 34 (4) : 359-380
24
勝又隆ほか:基礎と臨床. 1996 ; 30 (11) : 2955-2962
25
Harada M, et al. : Bone Miner. 1992 ; 18 (1) : 41-49
26
津島直美ほか:基礎と臨床. 1996 ; 30 (11) : 2963-2974
27
勝又隆ほか:基礎と臨床. 1996 ; 30 (11) : 2975-2982