1
社内資料:生物学的同等性試験(カプセル0.25μg)
2
社内資料:生物学的同等性試験(カプセル0.5μg)
活性型ビタミンD3製剤
1カプセル 6円
有効成分 | 1カプセル中 |
|---|---|
有効成分 | カルシトリオール 0.25μg |
添加剤 | 無水エタノール、中鎖脂肪酸トリグリセリド、ジブチルヒドロキシトルエン、ゼラチン、濃グリセリン、D-ソルビトール液、酸化チタン、更にカルシトリオールカプセル0.5μg「トーワ」はカラメルを含有 |
有効成分 | 1カプセル中 |
|---|---|
有効成分 | カルシトリオール 0.5μg |
添加剤 | 無水エタノール、中鎖脂肪酸トリグリセリド、ジブチルヒドロキシトルエン、ゼラチン、濃グリセリン、D-ソルビトール液、酸化チタン、更にカルシトリオールカプセル0.5μg「トーワ」はカラメルを含有 |
| 剤形 | 軟カプセル剤で、内容物は無色~微黄色澄明の液であり、においはないか又はわずかに特異なにおいがある。 |
|---|---|
| 色調 | 微黄白色 |
| 外形 | 側面  断面  |
| 質量 | 約270mg |
| 識別コード | Tw.TR0.25 |
| 剤形 | 軟カプセル剤で、内容物は無色~微黄色澄明の液であり、においはないか又はわずかに特異なにおいがある。 |
|---|---|
| 色調 | 淡褐色 |
| 外形 | 側面  断面  |
| 質量 | 約270mg |
| 識別コード | Tw.TR0.5 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
ビタミンD及びその誘導体 アルファカルシドール 等 | 高カルシウム血症があらわれるおそれがある。 | 作用が相互に増強される。 |
PTH製剤 テリパラチド 等 PTHrP製剤 アバロパラチド酢酸塩 | 高カルシウム血症があらわれるおそれがある。 | 相加作用による。 |
カルシウム製剤 乳酸カルシウム水和物 炭酸カルシウム 等 | 高カルシウム血症があらわれるおそれがある。 | 本剤は腸管でのカルシウムの吸収を促進させる。 |
マグネシウムを含有する製剤 酸化マグネシウム 炭酸マグネシウム 等 | 高マグネシウム血症があらわれるおそれがある。 | 他のビタミンD誘導体と同様に腸管でのマグネシウムの吸収を促進させると考えられる。 |
マグネシウムを含有する製剤 酸化マグネシウム 炭酸マグネシウム 等 | ミルク・アルカリ症候群(高カルシウム血症、高窒素血症、アルカローシス等)があらわれるおそれがある。 | 血中マグネシウムの増加により代謝性アルカローシスが持続するため、尿細管でのカルシウム再吸収が増加する。 |
ジギタリス | 高カルシウム血症に伴う不整脈があらわれるおそれがある。 | 血清カルシウムの濃度が上昇すると、ジギタリスの作用が増強される。 |
0.1%以上 | 0.1%未満 | 頻度不明 | |
|---|---|---|---|
消化器 | 嘔気、下痢、食欲不振、便秘、嘔吐、胃不快感 | 胃痛、口渇、腹部不快感、心窩部痛、腹部膨満感、口内炎 | |
精神神経系 | いらいら感、不眠、頭痛 | ||
循環器 | 動悸 | ||
肝臓 | AST上昇、ALT上昇、LDH上昇 | ||
腎臓 | BUN上昇、血中クレアチニン上昇、血中尿酸上昇 | ||
皮膚 | そう痒感 | 蕁麻疹、発疹、皮膚乾燥 | |
眼 | 結膜充血 | ||
骨 | 関節周囲の石灰化(化骨形成) | ||
その他 | 脱力感、倦怠感、背部痛、カルシウム沈着、熱感、発熱、胸痛、月経不順、鼻出血、尿路結石、顔面潮紅、腰痛、下肢痛、四肢の冷え、浮腫 |
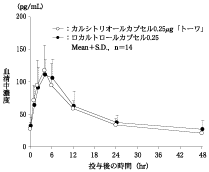
製剤投与量 (カルシトリ オールとして) | 判定パラメータ | 参考パラメータ | |||
AUC0-48 (pg・hr/mL) | Cmax (pg/mL) | Tmax (hr) | T1/2 (hr) | ||
カルシトリオール カプセル 0.25μg「トーワ」 | 16カプセル (4.0μg) | 2215±405 | 120.6±37.5 | 3.71±1.07 | 23.77±6.24 |
ロカルトロール カプセル0.25 | 16カプセル (4.0μg) | 2409±623 | 122.1±28.1 | 4.43±1.40 | 28.14±8.41 |
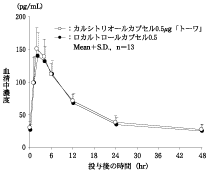
製剤投与量 (カルシトリ オールとして) | 判定パラメータ | 参考パラメータ | |||
AUC0-48 (pg・hr/mL) | Cmax (pg/mL) | Tmax (hr) | T1/2 (hr) | ||
カルシトリオール カプセル 0.5μg「トーワ」 | 8カプセル (4.0μg) | 2731±432 | 156.9±25.2 | 2.31±0.75 | 23.03±5.54 |
ロカルトロール カプセル0.5 | 8カプセル (4.0μg) | 2570±407 | 151.5±20.3 | 2.46±1.13 | 20.26±6.97 |
 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379