1
社内資料:尋常性乾癬患者を対象とした第Ⅲ相臨床試験(2016年3月28日承認、CTD2.7.6.1)[11111112-9712]
2
社内資料:ラットにおける単回経皮投与後の皮膚中濃度(2016年3月28日承認、CTD2.6.4.3.1)[11111112-9713]
3
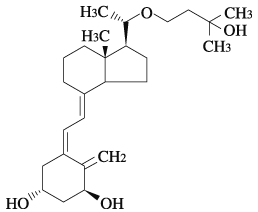
社内資料:マキサカルシトールの皮膚組織内分布[11111111-2435]
4
社内資料:マキサカルシトールの組織内分布[11111111-2436]
5
江角凱夫ら:薬物動態 1990; 5(6): 883-902[11111112-9716]
6
社内資料:薬物相互作用試験(in vitro)(マキサカルシトール)[11111111-2423]
7
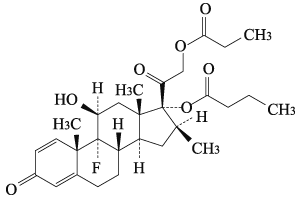
社内資料:ベタメタゾン酪酸エステルプロピオン酸エステルの代謝に関与する分子種の推定(in vitro)(2016年3月28日承認、CTD2.6.4.5.2)[11111112-9709]
8
社内資料:尋常性乾癬患者を対象とした第Ⅰ相臨床試験(マキサカルシトール軟膏)[11111111-2421]
9
大石孝義ら:基礎と臨床 1990; 24(11): 5869-5887[11111112-9694]
10
社内資料:薬理作用試験(ケラチノサイトの増殖抑制)[11111111-2425]
11
Kondo S., et al.:Arch. Dermatol. Res. 2000; 292(11): 550-555[11111111-2418]
12
社内資料:尋常性乾癬患者を対象とした臨床薬理試験(マキサカルシトール)[11111111-2426]
13
社内資料:薬理作用試験(ケラチノサイトの分化促進)[11111111-2416]
14
Komine M., et al.:Arch. Dermatol. Res. 1999; 291(9): 500-506[11111111-2417]
15
Adcock I.M.:Pulm. Pharmacol. Ther. 2000; 13(3): 115-126[11111111-2527]
16
社内資料:薬理作用試験(ビタミンD受容体に対する親和性)[11111111-2428]
17
社内資料:薬理作用試験(ビタミンD結合蛋白に対する結合能)[11111111-2427]
18
社内資料:薬理作用試験(ケラチノサイト核内への移行)[11111111-2429]
19
大森健守ら:基礎と臨床 1990; 24(11): 5847-5861[11111112-9689]