1
社内資料(健康成人を対象とした薬物動態試験)(2015年9月28日承認、CTD 2.7.6.1)[T27A001]
2
社内資料(健康成人を対象とした高用量安全性試験)(2015年9月28日承認、CTD 2.7.6.6)[T27C007]
3
Yataba I,et al. : Eur J Clin Pharmacol. 2016 ; 72(1) : 53-59
4
社内資料(血漿蛋白結合に関する検討:in vitro)(2015年9月28日承認、CTD 2.6.4.4.3)[T27A002]
5
Tracy TS, et al. : Biochem Pharmacol. 1996 ; 52 : 1305-1309
6
社内資料(肝ミクロソーム代謝に関する検討:in vitro)(2015年9月28日承認、CTD 2.6.4.5.6)[T27A007]
7
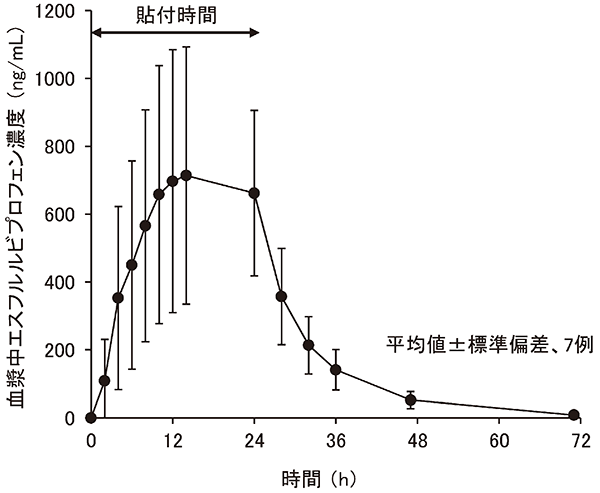
社内資料(健康成人を対象とした単回貼付試験)(2015年9月28日承認、CTD 2.7.6.3)[T27C004]
8
社内資料(変形性膝関節症患者を対象とした第Ⅱ相用量設定試験)(2015年9月28日承認、CTD 2.7.6.10)[T27C002]
9
社内資料(変形性膝関節症患者を対象とした第Ⅲ相試験)(2015年9月28日承認、CTD 2.7.6.11)[T27C003]
10
Sugimoto M, et al. : Drug Dev Res. 2016 ; 77(4) : 206-211
11
社内資料(鎮痛作用に関する検討)(2015年9月28日承認、CTD 2.6.2.2.1)[T27P002]
12
社内資料(抗炎症作用に関する検討)(2015年9月28日承認、CTD 2.6.2.2.2)[T27P003]