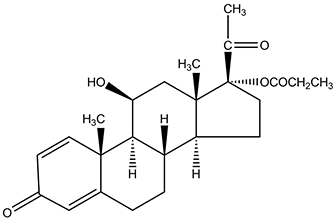
1
久光製薬社内資料. 吸収、分布、代謝及び排泄に関する資料.
2
石橋康正 ほか: 臨床医薬. 1989; 5(9): 1915-46.
3
石橋康正 ほか: 臨床医薬. 1989; 5(11): 2435-49.
4
牧野荘平: 治療. 1985; 67(10): 1935-40.
5
鹿取信: Therapeutic Research. 1986; 5(6): 955-61.
6
大野洋光 ほか: 基礎と臨床. 1989; 23(15): 5735-43.
外用副腎皮質ホルモン剤
1g 15.2円
有効成分 | 1g中 デプロドンプロピオン酸エステル 3mg(0.3%) |
|---|---|
添加剤 | 軽質流動パラフィン、ジブチルヒドロキシトルエン、白色ワセリン |
有効成分 | 1g中 デプロドンプロピオン酸エステル 3mg(0.3%) |
|---|---|
添加剤 | アジピン酸ジイソプロピル、クエン酸、クエン酸ナトリウム、ジブチルヒドロキシトルエン、セタノール、白色ワセリン、パラオキシ安息香酸ブチル、パラオキシ安息香酸メチル、プロピレングリコール、ポリオキシエチレンセチルエーテル、モノステアリン酸グリセリン |
| 識別コード | HP2100-O |
|---|---|
| 剤形・性状 | 白色~微黄色の軟膏で、においはない。 |
| 識別コード | HP2101C |
|---|---|
| 剤形・性状 | 白色のクリーム剤で、わずかに特異なにおいがある。 |
5%以上又は頻度不明 | 0.1~5%未満 | |
|---|---|---|
皮膚の感染症注1) | 皮膚の真菌性(カンジダ症、白癬等)・細菌性(伝染性膿痂疹、毛のう炎等)感染症、ウイルス感染症 | |
その他の皮膚症状注2) | ステロイドざ瘡注3) 、ステロイド酒さ・口囲皮膚炎(顔面の紅斑、丘疹、毛細血管拡張、痂皮、鱗屑) | ステロイド皮膚(皮膚萎縮、毛細血管拡張)、魚鱗癬様皮膚変化、紫斑、多毛、色素脱失等 |
過敏症 | 皮膚の刺激感、発疹等 | |
下垂体・副腎皮質系機能 | 大量又は長期にわたる広範囲の使用、密封法(ODT)により、下垂体・副腎皮質系機能の抑制 |
疾患名 | 有効率(%) (かなり軽快以上/評価例数) | |
軟膏 | クリーム | |
湿疹・皮膚炎群 | 91.4(352/385) | 88.8(310/349) |
薬疹・中毒疹 | 95.0(38/40) | 92.1(35/38) |
虫さされ | 95.5(42/44) | 88.6(39/44) |
痒疹群 | 82.6(38/46) | 71.4(30/42) |
乾癬 | 69.7(106/152) | 69.2(92/133) |
紅皮症 | 85.2(23/27) | 81.3(13/16) |
紅斑症 | 91.2(31/34) | 94.7(36/38) |
ジベル薔薇色粃糠疹 | 84.4(27/32) | 95.0(38/40) |
掌蹠膿疱症 | 75.7(28/37) | 59.5(22/37) |
特発性色素性紫斑 | 80.8(21/26) | 78.8(26/33) |
円形脱毛症 | 46.9(15/32) | 50.0(23/46) |
計 | 84.3(721/855) | 81.4(664/816) |