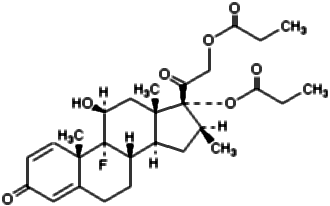
1
長谷川靖彦ほか:応用薬理.1974;8:705-720
2
長谷川靖彦ほか:基礎と臨床.1977;11:1672-1682
3
Vermeer,B.J.et al.:Dermatologica.1974;149:299-304
4
Zugerman,C.et al.:Arch.Dermatol.1976;112:1326
5
大滝倫子ほか:皮膚科の臨床.1975;17:75-84
6
木村秀人ほか:皮膚病診療.1987;9:449-452
7
山田秀雄ほか:応用薬理.1981;21:613-620
8
山田秀雄ほか:応用薬理.1981;21:633-644
9
片山一朗:アレルギー.2006;55:1279-1283
10
東禹彦ほか:西日本皮膚科.1973;35:596-602
11
東禹彦:皮膚.1984;26:254-258
12
Lutsky,B.N.et al.:Arzneim.-Forsch.1979;29:992-998
13
岩城製薬株式会社 社内資料(生物学的同等性試験)