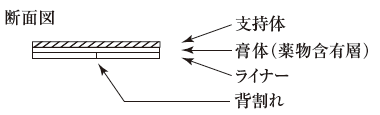
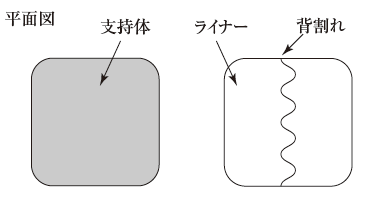
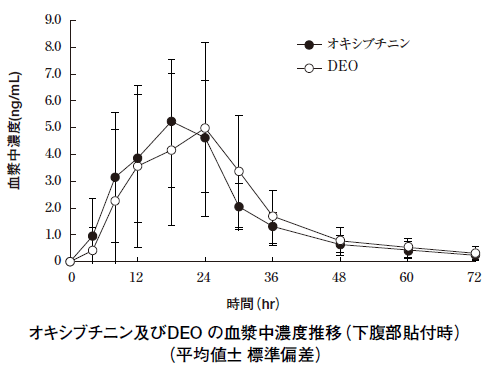
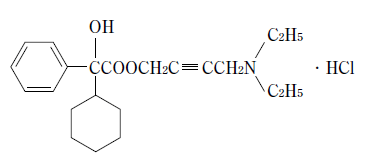1
久光製薬集計資料. 第II相貼付部位検討試験(2013年3月25日承認、CTD2.7.6.4).
2
久光製薬集計資料. 第I相反復投与試験(2013年3月25日承認、CTD2.7.6.3).
3
久光製薬集計資料. 第III相長期投与試験(2013年3月25日承認、CTD2.7.6.7).
4
久光製薬集計資料. ラットにおける単回投与組織分布試験(2013年3月25日承認、CTD2.6.4.4.1.1).
5
久光製薬集計資料. ラットにおける反復投与組織分布試験(2013年3月25日承認、CTD2.6.4.4.1.2).
6
秋本義雄 ほか:医薬品研究1984; 15(4): 519-35.
7
Mizushima H, et al.:Xenobiotica 2007; 37(1): 59-73.
8
Lukkari E, et al.:Pharmacol Toxicol 1998; 82(4): 161-6.
9
Yaïch M, et al.:Pharmacogenetics 1998; 8(5): 449-51.
10
久光製薬集計資料. 第III相比較試験(2013年3月25日承認、CTD2.7.6.6).
11
Maruyama S, et al.:J Urol 2006; 175(1): 365-9.
12
Uchida M, et al.:J Pharmacol Sci 2004; 94(2): 122-8.
13
Mizushima H, et al.:Biol Pharm Bull 2007; 30(5): 955-62.
14
Smith E R, et al.:Arzneimittelforschung 1998; 48(10): 1012-8.
15
Waldeck K, et al.:J Urol 1997; 157(3): 1093-7.
16
久光製薬集計資料. シストメトリー法を用いたラット排尿機能評価(2013年3月25日承認、CTD2.6.2.2.1).