1
社内資料 :国内第Ⅲ相比較試験(2018年9月21日承認、CTD
2.7.6.2.18)
2.7.6.2.18)
2
社内資料 :国内長期投与試験(2018年9月21日承認、CTD
2.7.6.2.19)
2.7.6.2.19)
選択的β3アドレナリン受容体作動性過活動膀胱治療剤
1錠 161.2円
有効成分 | 1錠中 |
|---|---|
有効成分 | ビベグロン 50mg |
添加剤 | D-マンニトール、結晶セルロース、クロスカルメロースナトリウム、ヒドロキシプロピルセルロース、ステアリン酸マグネシウム、乳糖水和物、ヒプロメロース、酸化チタン、トリアセチン、黄色三二酸化鉄、青色2号アルミニウムレーキ、カルナウバロウ |
| 剤形 | フィルムコーティング錠 |
|---|---|
| 色調 | 淡緑色 |
| 外形 | 表面  裏面  側面  |
| 大きさ | 大きさ(直径) 約6.5mm 大きさ(厚さ) 約3.5mm |
| 質量 | 約105mg |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
アゾール系抗真菌剤 イトラコナゾール等 HIVプロテアーゼ阻害剤 リトナビル等 | ケトコナゾールと併用したとき、ビベグロンの血中濃度が上昇したとの報告がある。 | CYP3A4及びP-gpを阻害する薬物と併用することにより、ビベグロンの血中濃度が上昇する可能性がある。 |
リファンピシン フェニトイン カルバマゼピン | ビベグロンの作用が減弱する可能性がある。 | CYP3A4及びP-gpを誘導する薬物と併用することにより、ビベグロンの血中濃度が低下する可能性がある。 |
1~2%未満 | 1%未満 | 頻度不明 | |
|---|---|---|---|
精神神経系 | 頭痛、めまい、不眠症、傾眠 | ||
消化器 | 口内乾燥、便秘 | 悪心、腹部膨満、消化不良、胃炎、胃食道逆流性疾患、下痢、腹痛 | |
循環器 | QT延長、動悸 | ||
泌尿器・ 腎臓 | 尿路感染(膀胱炎等)、残尿量増加 | 排尿躊躇、膀胱痛、遺尿、排尿困難 | |
皮膚 | 発疹、多汗症、そう痒症 | ||
眼 | 羞明 | 眼乾燥、霧視 | |
肝臓 | AST上昇、 ALT上昇 | 肝機能異常、γ-GTP上昇、Al-P上昇 | |
その他 | 疲労、ほてり、高脂血症、体液貯留、筋肉痛、浮腫、CK上昇、口渇、血圧上昇 |
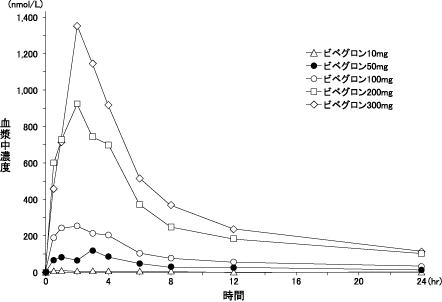
投与量 | Cmax (nmol/L) | tmax# (hr) | AUCinf (μmol・hr/L) | t1/2 (hr) |
10mg | 6.57 (60.9) | 1.00 (1.00-4.00) | 0.212 (30.3) | 60.5 (40.8) |
50mg | 134 (34.7) | 3.00 (0.800-3.00) | 1.92 (27.2) | 64.0 (12.6) |
100mg | 360 (70.3) | 2.50 (0.500-4.00) | 3.89 (23.1) | 58.9 (21.3) |
200mg | 1090 (40.3) | 2.00 (0.500-4.00) | 11.5 (16.2) | 59.1 (16.7) |
300mg | 1580 (36.8) | 2.00 (1.00-4.00) | 13.7 (25.5) | 60.7 (15.7) |
投与量 | 投与日 (日) | Cmax (nmol/L) | tmax## (hr) | AUC0-24 (μmol・hr/L) | t1/2 (hr) |
50mg | 1 | 90.1 (73.7) | 1.00 (0.500-4.00) | 0.559 (69.4) | - |
14# | 110 (67.2) | 3.00 (0.500-3.00) | 1.28 (43.5) | 69.6 (9.9) | |
100mg | 1 | 324 (135.6) | 1.50 (0.500-6.00) | 1.89 (86.1) | - |
14# | 354 (60.3) | 2.00 (2.00-4.00) | 3.72 (29.6) | 64.9 (34.9) | |
200mg | 1 | 778 (57.4) | 2.00 (1.00–4.00) | 5.31 (46.3) | - |
14 | 1380 (28.1) | 1.00 (0.500–6.00) | 9.76 (14.8) | 59.7 (3.3) |
Cmax (nmol/L) | tmax# (hr) | AUCinf (μmol・hr/L) | t1/2 (hr) |
89.7 (84.3) | 1.00 (0.500-2.00) | 1.37 (39.7) | 68.9 (15.0) |
投与群 | 症例数 | 投与前 | 変化量# | プラセボ群 との比較## |
プラセボ群 | 369 | 11.20 ±2.40 | -1.21 (-1.40,-1.03) | - |
ビベグロン 50mg群 | 370 | 11.13 ±2.37 | -2.08 (-2.27,-1.89) | p<0.0001 |
ビベグロン 100mg群 | 368 | 11.08 ±2.25 | -2.03 (-2.22,-1.84) | p<0.0001 |
投与群 | 症例数 | 投与前 | 変化量# | プラセボ群 との比較## |
プラセボ群 | 369 | 3.77 ±2.23 | -1.77 (-1.96,-1.58) | - |
ビベグロン 50mg群 | 370 | 3.70 ±2.08 | -2.28 (-2.46,-2.09) | p=0.0001 |
ビベグロン 100mg群 | 368 | 3.77 ±2.25 | -2.44 (-2.63,-2.25) | p<0.0001 |
投与群 | 症例数 | 投与前 | 変化量# | プラセボ群 との比較## |
プラセボ群 | 333 | 1.88 ±1.33 | -1.08 (-1.21,-0.96) | - |
ビベグロン 50mg群 | 329 | 1.97 ±1.48 | -1.35 (-1.48,-1.23) | p=0.0015 |
ビベグロン 100mg群 | 327 | 1.86 ±1.31 | -1.47 (-1.60,-1.34) | p<0.0001 |
投与群 | 症例数 | 投与前 | 8週時変化量# | 52週時変化量# |
ビベグロン 50mg維持例 | 115 | 10.62 ±1.88 | -2.52 (-2.90,-2.13) | -2.71 (-3.21,-2.21) |
ビベグロン 100mg増量例 | 51 | 12.78 ±2.95 | -1.85 (-2.42,-1.28) | -3.16 (-3.90,-2.41) |
投与群 | 症例数 | 投与前 | 8週時変化量# | 52週時変化量# |
ビベグロン 50mg維持例 | 115 | 3.79 ±2.59 | -2.72 (-3.14,-2.29) | -2.91 (-3.43,-2.39) |
ビベグロン 100mg増量例 | 51 | 5.56 ±3.57 | -2.19 (-2.82,-1.55) | -3.42 (-4.20,-2.65) |
投与群 | 症例数 | 投与前 | 8週時変化量# | 52週時変化量# |
ビベグロン 50mg維持例 | 93 | 1.81 ±1.39 | -1.49 (-1.78,-1.20) | -1.55 (-1.88,-1.22) |
ビベグロン 100mg増量例 | 45 | 2.79 ±2.60 | -1.49 (-1.91,-1.07) | -2.29 (-2.76,-1.81) |
有機溶媒相 | 水相 | 分配比 |
1-オクタノール | pH7.0(McIlvaineの緩衝液) | 0.550 |