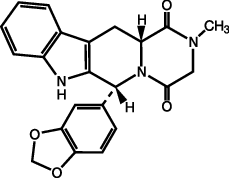
1
Kloner RA, et al.:Am J Cardiol. 2003;92(Suppl):37M–46M
2
Patterson D, et al.:Br J Clin Pharmacol. 2005;60(5):459-468
3
Kloner RA, et al.:J Am Coll Cardiol. 2003;42(10):1855-1860
4
リトナビル及びケトコナゾールとの薬物相互作用(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要 2.7.2.2.2.3.2)
5
リファンピシン及びケトコナゾールとの薬物相互作用(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要 2.7.2.2.2.3.1)
6
Kloner RA, et al.:J Urol. 2004;172(5 Pt 1):1935-1940
7
Kloner RA, et al.:Am J Cardiol. 2003;92(Suppl):47M-57M
8
Pomeranz HD, et al.:J Neuroophthalmol. 2005;25(1):9-13
9
McGwin G, et al.:Br J Ophthalmol. 2006;90(2):154-157
10
Lee AG, et al.:Am J Ophthalmol. 2005;140(4):707-708
11
Campbell UB, et al.:J Sex Med. 2015;12(1):139-151
12
Gilad R, et al.:BMJ. 2002;325(7369):869
13
Striano P, et al.:BMJ. 2006;333(7572):785
14
アルコールとの薬物相互作用(タダラフィル10mg)(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.2.2.3.9、申請資料概要2.7.2.2.2.4.7)
15
アルコールとの薬物相互作用(タダラフィル20mg)(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.2.2.3.9、申請資料概要2.7.2.2.2.4.7)
16
Hellstrom WJG, et al.:J Urol. 2003;170(3):887-891
17
精液特性に及ぼす影響(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.4.4.3)
18
健康成人における薬物動態(単回投与)(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.2.2.1.1)
19
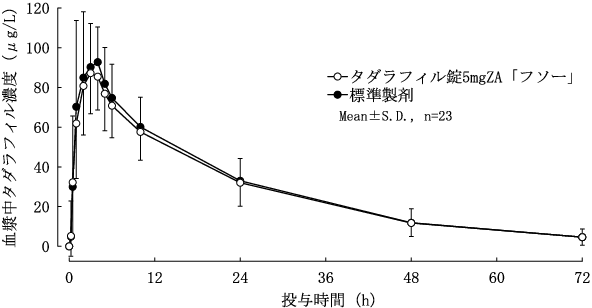
社内資料:生物学的同等性試験(タダラフィル錠5mgZA「フソー」、2020年2月17日承認、CTD 2.7.1.2.2)
20
日本人及び外国人患者における薬物動態(反復投与)(ザルティア錠2.5mg及びザルティア錠5mg、2014年1月17日承認、申請資料概要2.7.2.2.2)
21
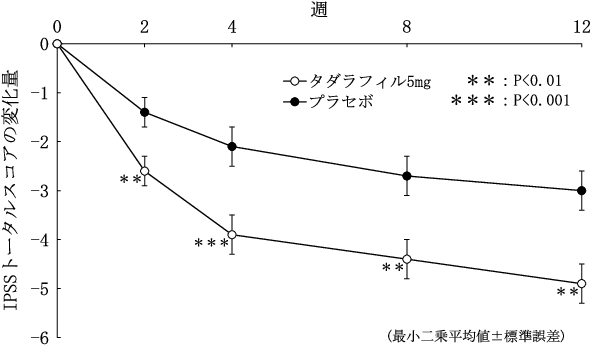
前立腺肥大症に伴う排尿障害を有する日本人患者における第Ⅱ相試験(ザルティア錠2.5mg及びザルティア錠5mg、2014年1月17日承認、申請資料概要2.7.2.2.1)
22
食事の影響(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要 2.7.1.1.3)
23
蛋白結合(in vitro;ラット、イヌ及びヒト血漿)(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.6.4.4.3)
24
蛋白結合(in vitro;ヒト血漿蛋白)(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.2.1.1)
25
放射性標識体投与時の薬物動態(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.2.2.1.3)
26
腎機能障害患者における薬物動態(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.3.5.2)
27
Forgue ST, et al.:Br J Clin Pharmacol. 2007;63(1):24-35
28
高齢及び非高齢患者における薬物動態(反復投与)(ザルティア錠2.5mg及びザルティア錠5mg、2014年1月17日承認、申請資料概要2.7.2.2.3)
29
リトナビルとの薬物相互作用(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.2.2.3.3)
30
タムスロシンとの薬物相互作用(アドシルカ錠20mg、2009年10月16日承認、申請資料概要2.7.2.1.1.2.5.3)
31
制酸剤及びH2受容体拮抗剤との薬物相互作用(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.2.2.3.8)
32
ミダゾラムとの薬物相互作用(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.2.2.3.5)
33
テオフィリンとの薬物相互作用(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.2.2.3.7)
34
ワルファリンとの薬物相互作用(タダラフィル10mg)(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.2.2.3.6)
35
ワルファリンとの薬物相互作用(タダラフィル20mg)(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.2.2.3.6)
36
アムロジピンとの薬物相互作用(シアリス錠5mg、シアリス錠10mg及びシアリス錠20mg、2007年7月31日承認、申請資料概要2.7.2.2.2.3.10)
37
社内資料:溶出試験(タダラフィル錠2.5mgZA)(タダラフィル錠2.5mgZA「フソー」、2020年2月17日承認、CTD 2.7.1.2.1.2)
38
Takeda M, et al.:Low Urin Tract Symptoms. 2012;4(3):110-119
39
Yokoyama O, et al.:Int J Urol. 2013;20(2):193-201
40
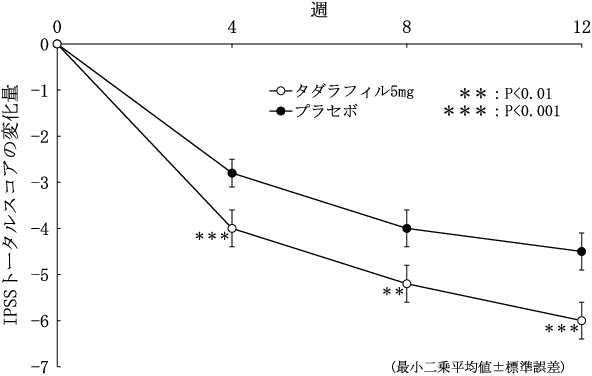
前立腺肥大症に伴う排尿障害患者における第Ⅲ相試験(ザルティア錠2.5mg及びザルティア錠5mg、2014年1月17日承認、申請資料概要2.7.3.2.1.3)
41
Saenz de Tejada I, et al.:Int J Impot Res. 2002;14(Suppl 4):S20