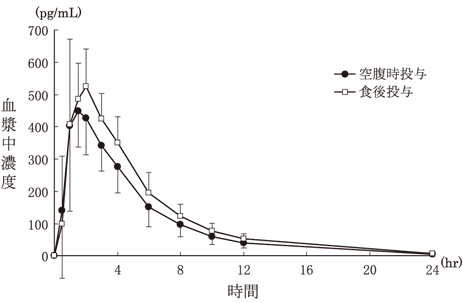
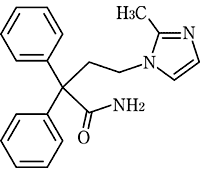
1
島田英世ほか:臨床医薬,2011;27:171-182
2
島田英世ほか:臨床医薬,2007;23:249-262
3
島田英世ほか:臨床医薬,2007;23:273-285
4
Ohno T.et al.:Br.J.Clin.Pharmacol.,2008;65:197-202
5
Kanayama N.et al.:Xenobiotica,2007;37:139-154
6
Ohmori S.et al.:Drug Metab.Dispos.,2007;35:1624-1633
7
島田英世ほか:臨床医薬,2007;23:233-248
8
島田英世ほか:臨床医薬,2007;23:263-272
9
Ohno T.et al.:J.Clin.Pharmacol.,2008;48:330-334
10
Hasegawa C.et al.:Drug Metab.Pharmacokinet.,2013;28:203-212
11
Homma Y.et al.:Int.J.Urol.,2009;16:499-506
12
Homma Y.et al.:Int.J.Urol.,2008;15:986-991
13
山口 脩ほか:薬理と治療,2009;37:909-930
14
小林文義ほか:日本排尿機能学会誌,2007;18:292-298
15
Kobayashi F.et al.:Arzneimittelforschung, 2007;57:92-100
16
宇野隆司ほか:日本薬理学雑誌,2008;131:379-387
17
Kobayashi F.et al.:Arzneimittelforschung, 2007;57:147-154