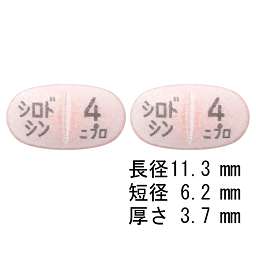
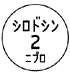
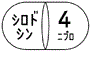
1
マウスでの104週間投与試験(ユリーフカプセル:2006年1月23日承認、CTD2.6.6.5)(L20200900)
2
ラットでの受胎能及び着床までの初期胚発生に関する試験(ユリーフカプセル:2006年1月23日承認、CTD2.6.6.6)(L20210098)
3
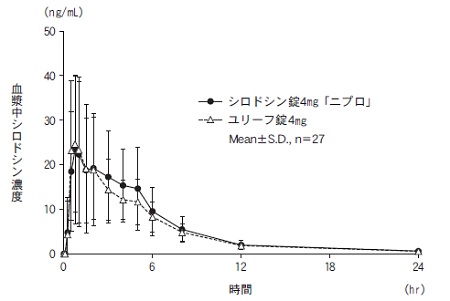
社内資料:生物学的同等性試験(錠4mg)
4
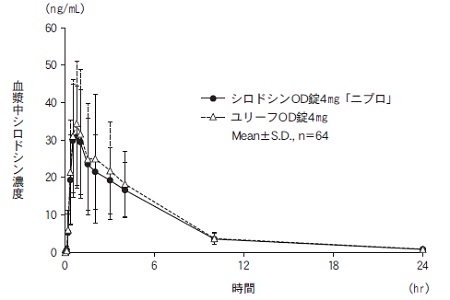
社内資料:生物学的同等性試験(OD錠4mg、水あり投与)
5
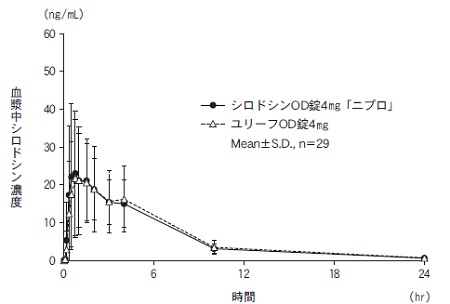
社内資料:生物学的同等性試験(OD錠4mg、水なし投与)
6
前立腺肥大症に伴う排尿障害患者を対象とした長期投与試験(ユリーフカプセル:2006年1月23日承認、CTD2.7.2.2)(L20200902)
7
清水智司ほか.薬学雑誌. 2006;126(S):257-263(L20200901)
8
社内資料:生物学的同等性試験(錠2mg)
9
社内資料:生物学的同等性試験(OD錠2mg)
10
効力を裏付ける試験(ユリーフカプセル:2006年1月23日承認、CTD2.6.2.1)(L20230953)