1
マウスでの104週間投与試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.6.6.5)
2
ラットでの受胎能及び着床までの初期胚発生に関する試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.6.6.6)
3
清水智司 他:薬学雑誌. 2006;126(S):257-263
4
健康成人を対象とした第Ⅰ相臨床試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.2.2)
5
健康成人を対象とした第Ⅰ相臨床試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.2.2)
6
第Ⅰ相臨床試験(反復)(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.6.2)
7
前立腺肥大症に伴う排尿障害患者を対象とした長期投与試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.2.2)
8
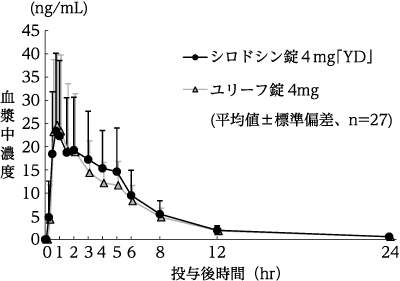
(株)陽進堂社内資料:生物学的同等性試験(錠4mg)
9
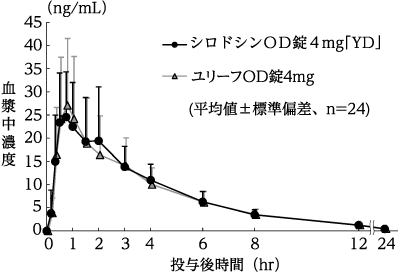
(株)陽進堂社内資料:生物学的同等性試験(OD錠4mg)
10
健康成人を対象とした臨床薬理試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.1.2)
11
臨床薬理試験(マスバランス試験)(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.6.2)
12
(株)陽進堂社内資料:生物学的同等性試験(錠2mg)
13
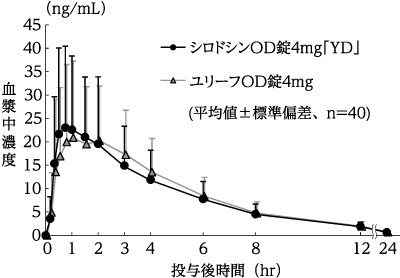
(株)陽進堂社内資料:生物学的同等性試験(OD錠2mg)
14
前立腺肥大症に伴う排尿障害患者を対象とした後期第Ⅱ相臨床試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.6.3)
15
後期第Ⅱ相臨床試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.3.2)
16
前立腺肥大症に伴う排尿障害患者を対象とした第Ⅲ相臨床試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.6.3)
17
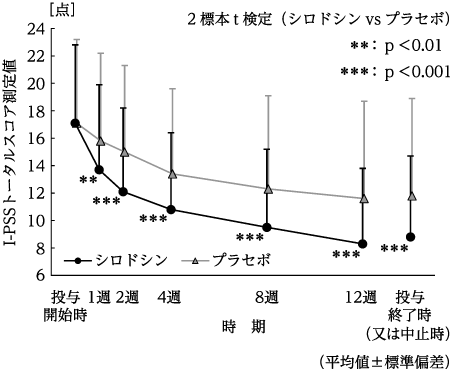
塩酸タムスロシン及びプラセボとの比較に関する有効性評価について(第Ⅲ相検証試験)(ユリーフカプセル:2006年1月23日承認、申請資料概要2.5.4.1)
18
有効性及び安全性試験成績の概要 第Ⅲ相試験(ユリーフカプセル:2006年1月23日承認、審査報告書)
19
前立腺肥大症に伴う排尿障害患者を対象とした第Ⅲ相長期投与試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.6.3)
20
作用機作(ユリーフカプセル:2006年1月23日承認、申請資料概要2.6.2.1)
21
立道聡 他:薬学雑誌. 2006;126(S):209-216
22
Murata, S. et al.:J. Urol. 2000;164(2):578-583
23
立道聡 他:薬学雑誌. 2006;126(S):217-223
24
イヌ下腹神経刺激誘発尿道内圧上昇モデルにおける作用(ユリーフカプセル:2006年1月23日承認、申請資料概要2.6.2.2)
25
ラット前立腺肥大モデルにおける作用(ユリーフカプセル:2006年1月23日承認、申請資料概要2.6.2.2)




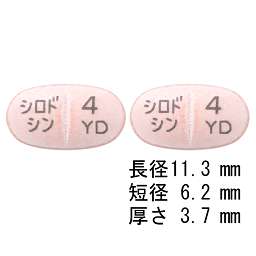

 :-13~-17°(脱水物に換算したもの0.2g、メタノール、20mL、100mm)。
:-13~-17°(脱水物に換算したもの0.2g、メタノール、20mL、100mm)。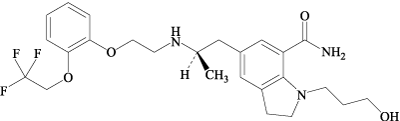
 0120-647-734
0120-647-734

