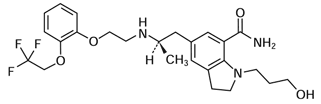
1
マウスでの104週間投与試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.6.6.5)
2
ラットでの受胎能及び着床までの初期胚発生に関する試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.6.6.6)
3
清水智司他:薬学雑誌 2006;126(S):257-263
4
健康成人を対象とした第Ⅰ相臨床試験(1)(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.2.2)
5
健康成人を対象とした第Ⅰ相臨床試験(2)(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.2.2)
6
反復投与(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.6.2)
7
前立腺肥大症に伴う排尿障害患者を対象とした長期投与試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.2.2)
8
田中孝典他:新薬と臨床 2019;68:638-657
9
健康成人を対象とした臨床薬理試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.1.2)
10
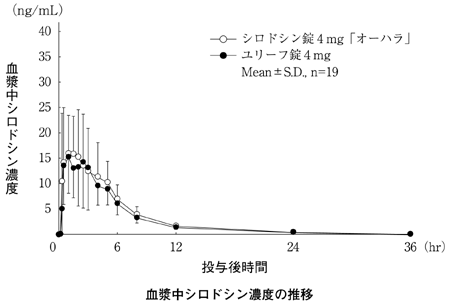
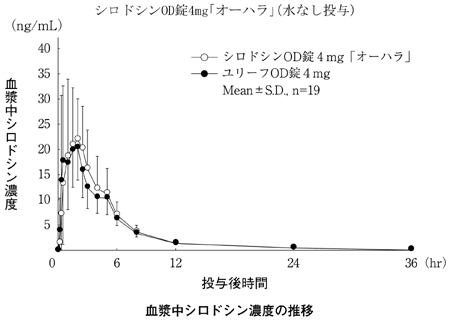
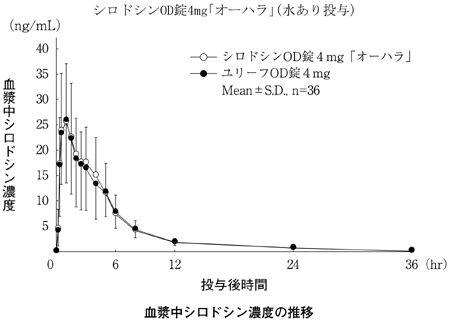
大原薬品工業株式会社 社内資料:生物学的同等性試験
11
前立腺肥大症に伴う排尿障害患者を対象とした後期第Ⅱ相臨床試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.3.2、2.7.6.3)
12
前立腺肥大症に伴う排尿障害患者を対象とした第Ⅲ相臨床試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.5.4.1、2.7.6.3)
13
有効性及び安全性試験成績の概要 第Ⅲ相試験(ユリーフカプセル:2006年1月23日承認、審査報告書)
14
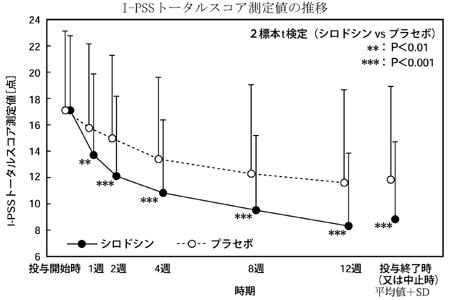
前立腺肥大症に伴う排尿障害患者を対象とした第Ⅲ相長期投与試験(ユリーフカプセル:2006年1月23日承認、申請資料概要2.7.6.3)
15
前立腺肥大症に伴う排尿障害患者を対象とした第Ⅲ相長期投与試験(ユリーフカプセル:2006年1月23日承認、審査報告書)
16
作用機序(ユリーフカプセル:2006年1月23日承認、申請資料概要2.6.2.1)
17
立道聡他:薬学雑誌 2006;126(S):209-216
18
Murata S, et al.:J Urol. 2000;164(2):578-583
19
立道聡他:薬学雑誌 2006;126(S):217-223
20
イヌ下腹神経刺激誘発尿道内圧上昇モデルにおける作用(ユリーフカプセル:2006年1月23日承認、申請資料概要2.6.2.2)
21
ラット前立腺肥大モデルにおける作用(ユリーフカプセル:2006年1月23日承認、申請資料概要2.6.2.2)