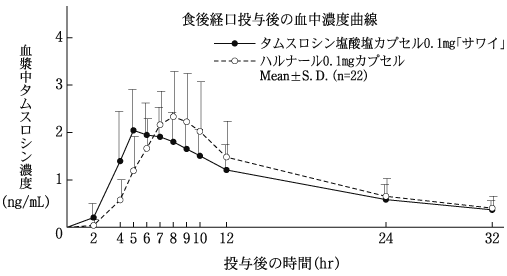
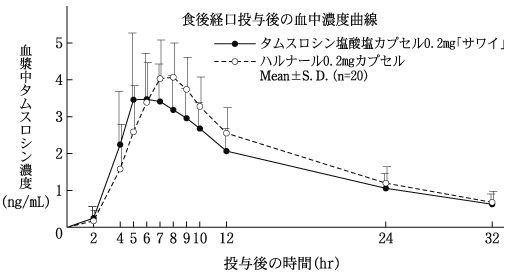
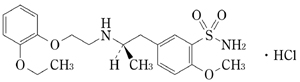
1
角尾道夫他:臨床医薬, 1990;6(12):2529-2551
2
角尾道夫他:臨床医薬, 1991;7(1):63-83
3
横山修他:薬理と治療, 2005;33(6):521-526
4
横山修他:薬理と治療, 2005;33(6):535-540
5
横山修他:薬理と治療, 2005;33(6):527-533
6
細川宣彦他:医学と薬学, 2005;53(6):763-770
7
細川宣彦他:医学と薬学, 2005;53(6):771-777
8
Koiso, K. et al.:J. Clin. Pharmacol., 1996;36(11):1029-1038
9
Kawachi, Y.:Curr. Ther. Res., 1998;59(3):149-161
10
河邉香月他:泌尿器外科, 1990;3(10):1247-1259
11
Kawabe, K. et al.:J. Urol., 1990;144(4):908-912
12
河邉香月他:泌尿器外科, 1991;4(2):231-242
13
Yamada, S. et al.:J. Pharmacol. Exp. Ther., 1987;242(1):326-330
14
Honda, K. et al.:Naunyn-Schmiedeberg’s Arch. Pharmacol., 1985;328(3):264-272
15
Honda, K. et al.:Naunyn-Schmiedeberg’s Arch. Pharmacol., 1987;336(3):295-302
16
Honda, K. et al.:J. Pharmacol. Exp. Ther., 1986;239(2):512-516
17
Honda, K. et al.:Naunyn-Schmiedeberg’s Arch. Pharmacol., 1985;330(1):16-21
18
宮田桂司他:日薬理誌, 2005;126:341-345
19
Shibasaki, M. et al.:J. Auton. Pharmacol., 1992;12(4):263-268
20
Sudoh, K. et al.:J. Auton. Pharmacol., 1996;16(3):147-154
21
Sudoh, K. et al.:Gen. Pharmacol., 1997;28(4):521-524