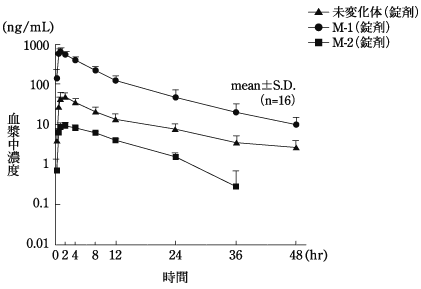
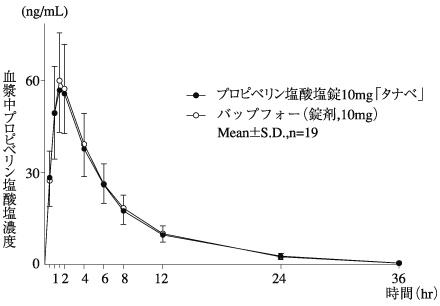
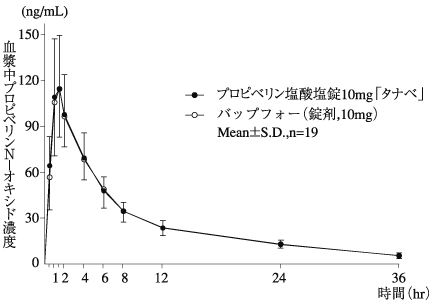
1
宇田和彦 他 : 薬物動態. 1989 ; 4(5): 581-593
2
西村貴子 他 : 薬理と治療. 2006 ; 34(7): 859-867
3
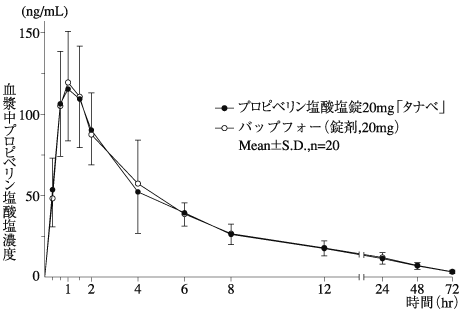
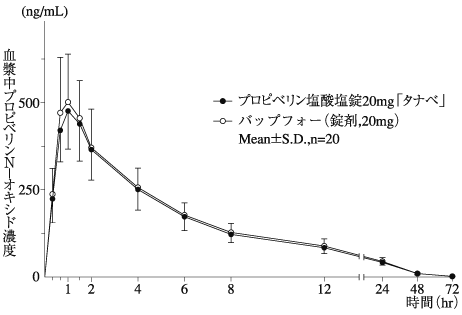
プロピベリン塩酸塩錠の生物学的同等性に関わる資料(社内資料)
4
釘宮豊城 他 : 臨床薬理. 1990 ; 21(3): 555-565
5
プロピベリン塩酸塩錠の溶出性に関わる資料(社内資料)
6
高安久雄 他 : 診療と新薬. 1990 ; 27(1): 75-83
7
高安久雄 他 : 臨床医薬. 1990 ; 6(4): 745-760
8
高安久雄 他 : 臨床医薬. 1990 ; 6(4): 761-776
9
高安久雄 他 : 医学のあゆみ. 1990 ; 153(8): 459-471
10
高安久雄 他 : 西日本泌尿器科. 1990 ; 52(2): 248-258
11
岩坪暎二 他 : 西日本泌尿器科. 1990 ; 52(2): 233-240
12
阿曾佳郎 他 : 泌尿器外科. 1990 ; 3(5): 671-675
13
大森弘之 他 : 西日本泌尿器科. 1990 ; 52(2): 241-247
14
高木隆治 他 : 泌尿器外科. 1990 ; 3(3): 321-327
15
渡邉泱 他 : 新薬と臨牀. 1990 ; 39(4): 699-706
16
小島弘敬 他 : 新薬と臨牀. 1990 ; 39(6): 1153-1159
17
横山修 他 : 泌尿器科紀要. 1990 ; 36(4): 517-523
18
大友英一 他 : 薬理と治療. 1990 ; 18(4): 1731-1740
19
Gotoh, M., et al. : Int. J. Urol. 2011 ; 18(5): 365-373
20
横山修 他 : 泌尿器外科. 2011 ; 24(6): 1023-1030
21
第十六改正日本薬局方解説書,廣川書店 2011;C-4299-C-4303
22
金子茂 他 : 日本薬理学雑誌. 1989 ; 93(2): 55-60
23
野村鳴夫 他 : 日本薬理学雑誌. 1989 ; 94(3): 173-180
24
金子茂 他 : 日本薬理学雑誌. 1990 ; 95(2): 55-61
25
土田正義 他 : 泌尿器科紀要. 1990 ; 36(8): 915-919