1
大島洋次郎他:薬理と治療.1990;18(Suppl.3):589-607,609-623,625-631,633-639
2
田中敏章他:日本成長学会雑誌.2010;16(2):85-92
3
茶谷文雄他:薬理と治療.1990;18(Suppl.3):575-588
4
新島端夫他:泌尿器科紀要.1990;36(11):1343-1360
5
水野正彦他:産婦人科の世界.1992;44(10):751-788
6
星合 昊他:産婦人科の世界.1993;45(1):61-82
7
中村元一他:薬理と治療.1992;20(8):3329-3341
8
田口鐵男他:癌と化学療法.1995;22(4):477-494
9
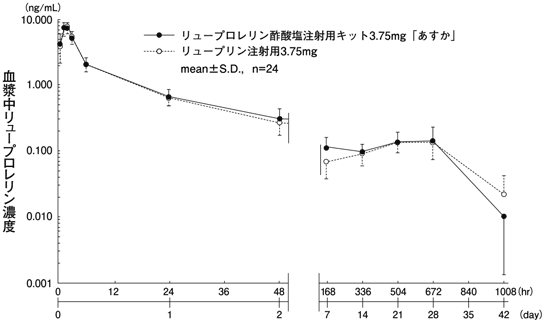
社内資料:血中濃度推移に関する資料
10
第十八改正日本薬局方解説書.廣川書店;2021.C6160-C6167
11
水野正彦他:産婦人科の世界.1992;44(12):923-955
12
熊坂高弘他:産婦人科の世界.1992;44(11):851-864
13
武谷雄二他:薬理と治療.1992;20(8):3343-3354
14
松尾明美他:臨床婦人科産科.1992;46(9):1140-1148
15
水口弘司他:日本不妊学会雑誌.1992;37(4):580-590
16
武谷雄二他:産婦人科の世界.1997;49(4):315-330
17
寺川直樹他:産科と婦人科.1995;62(4):569-596
18
中村元一他:産婦人科の世界.1995;47(4):323-355
19
谷口晴記他:産婦人科の世界.1995;47(5):423-442
20
武谷雄二他:産科と婦人科.1995;62(5):741-769
21
Tanaka,T.et al.:Endocrinologia Japonica.1991;38(4):369-376
22
田中敏章他:ホルモンと臨床.1992;40(8):835-841
23
田口鐵男他:癌と化学療法.1995;22(4):495-508
24
海外第Ⅲ相無作為割付群間比較試験(リュープリンSR注射用キット11.25:2005年8月18日承認、審査報告書)
25
阿曽佳郎他:泌尿器科紀要.1991;37(3):305-320
26
赤座英之他:泌尿器外科.1991;4(5):527-539
27
須藤勝一他:薬理と治療.1990;18(Suppl.3):515-520
28
前多敬一郎他:薬理と治療.1990;18(7):2615-2629
29
山崎 巌他:武田研究所報.1977;36(1/2):64-70
30
須藤勝一他:薬理と治療.1990;18(Suppl.3):521-528
31
薬理作用(リュープリンPRO注射用キット22.5mg:2015年9月28日承認、CTD2.6.2.1)