1
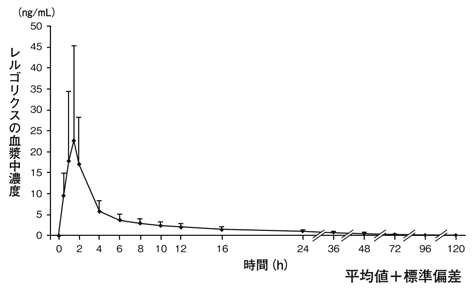
社内資料:薬物動態試験成績①(2019年1月8日承認,CTD2.7.6.11)
2
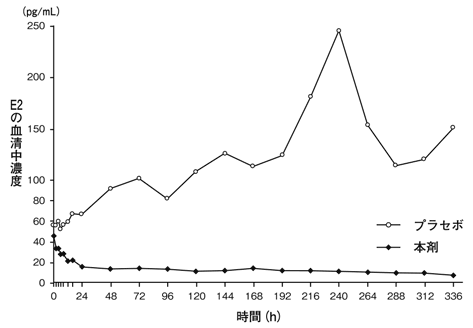
社内資料:薬物動態試験成績②(2019年1月8日承認,CTD2.7.6.1)
3
社内資料:食事の影響試験成績(2019年1月8日承認,CTD2.7.6.11)
4
社内資料:吸収に関する検討①(2019年1月8日承認,CTD2.7.6.3)
5
社内資料:吸収に関する検討②(2019年1月8日承認,CTD2.6.4.3.7)
6
社内資料:分布に関する検討(2019年1月8日承認,CTD2.6.4.4.4)
7
社内資料:代謝に関する検討(2019年1月8日承認,CTD2.6.4.5.4)
8
社内資料:排泄に関する検討(2019年1月8日承認,CTD2.7.2.2.2.1(3))
9
社内資料:腎機能障害患者における薬物動態試験成績(2019年1月8日承認,CTD2.7.6.6)
10
社内資料:肝機能障害患者における薬物動態試験成績(2019年1月8日承認,CTD2.7.6.5)
11
社内資料:薬物間相互作用に関する検討①(2019年1月8日承認,CTD2.7.6.9)
12
社内資料:薬物間相互作用に関する検討②(2019年1月8日承認,CTD2.7.6.7)
13
社内資料:薬物間相互作用に関する検討③(2019年1月8日承認,CTD2.7.6.8)
14
社内資料:DDI Cocktail試験成績(2019年1月8日承認,CTD2.7.6.10)
15
社内資料:臨床試験成績①(2019年1月8日承認,CTD2.7.6.13)
16
社内資料:臨床試験成績②(2019年1月8日承認,CTD2.7.6.14)
17
社内資料:臨床試験成績③(2021年12月24日承認,CTD2.7.6.2)
18
社内資料:薬理試験成績①(2019年1月8日承認,CTD2.6.2)
19
社内資料:薬理試験成績②(2019年1月8日承認,CTD2.6.2.2.1)
20
社内資料:薬理試験成績③(2019年1月8日承認,CTD2.6.2.2.2)
21
社内資料:薬理試験成績④(2019年1月8日承認,CTD2.6.2.2.4)
22
社内資料:薬力学的作用に関する検討(2019年1月8日承認,CTD2.7.2.2.2.1(1))