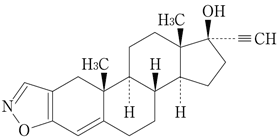
1
田村昭蔵, 他: 産婦人科の実際. 1980; 29(12): 1193-1206
2
Lloyd-Jones JG, et al.: J Int Med Res. 1977; 5(Suppl.3): 18-24
3
常磐知宣, 他: 応用薬理. 1981; 22(4): 605-620
4
杉本 修, 他: 診療と新薬. 1994; 31(9): 1520-1533
5
水口弘司, 他: 新薬と臨床. 1994; 43(9): 1812-1825
6
弥生恵司, 他: 薬理と治療. 1991; 19(8): 3175-3188
7
泉雄 勝, 他: 基礎と臨床. 1991; 25(9): 2784-2794
8
Guillebaud J, et al.: J Int Med Res. 1977; 5(Suppl.3): 57-66
9
Potts G O, et al.: Fertil Steril. 1974; 25(4): 367-372
10
Eldridge J C, et al.: Biol Reprod. 1974; 10(4): 438-446
11
Barbieri R L, et al.: Obstet Gynecol. 1981; 57(6): 722-724
12
Barbieri R L, et al.: Fertil Steril. 1977; 28(8): 809-813
13
Tamaya T, et al.: Fertil Steril. 1984; 41(5): 732-735
14
武谷雄二, 他: 産科と婦人科. 1985; 52(8): 1363-1365





 245
245