1
Goto T, et al.:Clin Pediatr Endocrinol. 2008;17:71-74.
2
Wortsman J, et al.:JAMA. 1977;238:2527.
3
Straw JA, et al.:Proc Soc Exp Biol Med. 1965;118:391-394.
4
Baudin E, et al.:Cancer. 2001;92:1385-1392.
5
社内資料:薬力学的研究
6
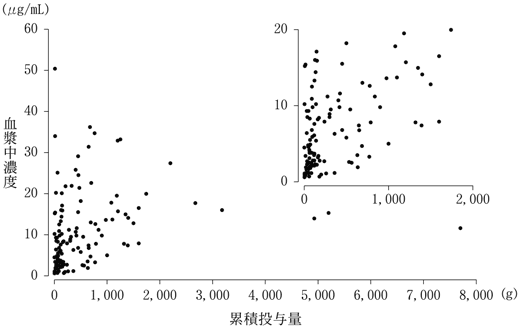
社内資料:血漿中濃度と累積投与量の関係に関する資料
7
Moolenaar AJ, et al.:Cancer Chem Pharm. 1981;7:51-54.
8
Moy RH:J Lab Clin Med. 1961;58:296-304.
9
木野内喬 他:ホルモンと臨床. 1982;30:841-851.
10
Kaminsky N, et al.:J Natl Cancer Inst. 1962;29:127-159.
11
小島元子 他:日本内分泌学会雑誌. 1984;60:852-871.
12
Hart MM, et al.:Steroids. 1971;17:559-574.
13
小島元子 他:日本内分泌学会雑誌. 1982;58:407.
14
小島元子 他:ホルモンと臨床. 1981;29:1499-1505.
15
長沼 廣 他:日本内分泌学会雑誌. 1982;58:405.
16
Touitou Y, et al.:J Steroid Biochem. 1978;9:1217-1224.
17
Bledsoe T, et al.:J Clin Endo. 1964;24:1303-1311.