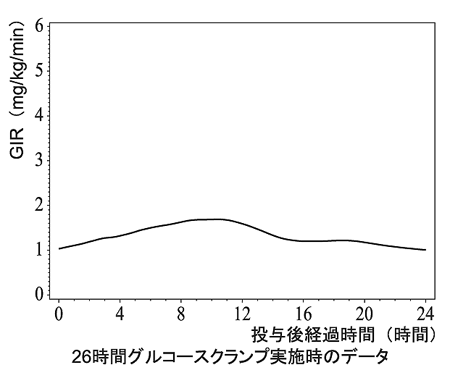
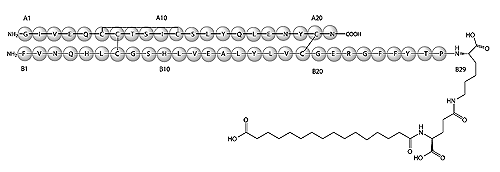
1
Herings RMC, et al.:Lancet. 1995;345:1195-1198
2
Ikushima I, et al.:J Diabetes Investig. 2016;7:270-275
3
Heise T, et al.:Expert Opin Drug Metab Toxicol. 2015;11:1193-1201
4
Heise T, et al.:Diabetes Obes Metab. 2012;14:859-864
5
Korsatko S, et al.:Drugs Aging. 2014;31:47-53
6
Biester T, et al.:Pediatr Diabetes. 2014;15:27-33
7
Kiss I, et al.:Clin Pharmacokinet. 2014;53:175-183
8
Kupcová V, et al.:Clin Drug Investig. 2014;34:127-133
9
Nosek L, et al.:Clin Drug Investig. 2014;34:673-679
10
Davies MJ, et al.:Diabetes Obes Metab. 2014;16:922-930
11
Davies M, et al.:Diabetes Obes Metab. 2016;18:96-99
12
Onishi Y, et al.:J Diabetes Investig. 2013;4:605-612
13
Kadowaki T, et al.:J Diabetes Investig. 2016;7:711-717
14
Meneghini L, et al.:Diabetes Care. 2013;36:858-864
15
Mathieu C, et al.:J Clin Endocrinol Metab. 2013;98:1154-1162
16
Thalange N, et al.:Pediatr Diabetes. 2015;16:164-176
17
Jonassen I, et al.:Pharm Res. 2012;29:2104-2114