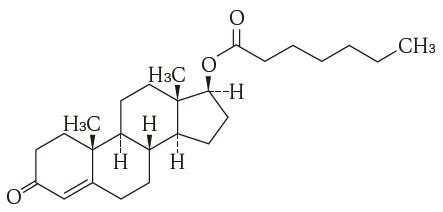
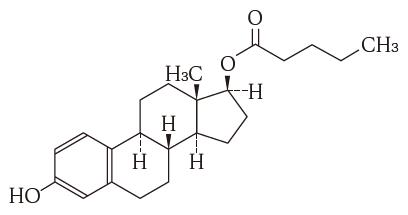
1
安田佳子他:医学のあゆみ. 1976;98(8):537-538
2
安田佳子他:医学のあゆみ. 1976;99(8):611-612
3
守隆夫:医学のあゆみ. 1975;95(11):599-602
4
Grady D, et al.:Obstet Gynecol. 1995;85(2):304-313
5
Chlebowski RT, et al.:JAMA. 2003;289(24):3243-3253
6
Anderson GL, et al.:JAMA. 2004;291(14):1701-1712
7
Stefanick ML, et al.:JAMA. 2006;295(14):1647-1657
8
Beral V, et al.:Lancet. 2003;362(9382):419-427
9
Manson JE, et al.:N Engl J Med. 2003;349(6):523-534
10
Wassertheil-Smoller S, et al.:JAMA. 2003;289(20):2673-2684
11
Hendrix SL, et al.:Circulation. 2006;113(20):2425-2434
12
Shumaker SA, et al.:JAMA. 2003;289(20):2651-2662
13
Shumaker SA, et al.:JAMA. 2004;291(24):2947-2958
14
Rodriguez C, et al.:JAMA. 2001;285(11):1460-1465
15
Lacey JV Jr, et al.:JAMA. 2002;288(3):334-341
16
Beral V, et al.:Lancet. 2007;369(9574):1703-1710
17
Anderson GL, et al.:JAMA. 2003;290(13):1739-1748
18
Cirillo DJ, et al.:JAMA. 2005;293(3):330-339
19
太田裕彦 他:肝臓. 1977;18:958
20
Falk H, et al.:Lancet. 1979;2(8152):1120-1123
21
岡 輝明 他:病理と臨床. 1988;6(3):337-346
22
Düsterberg B, et al.:Maturitas. 1982;4(4):315-324
23
Düsterberg B, et al.:Hormone Res. 1985;21(3):145-154
24
社内資料:男性被験者5例で42mgの重水素化テストステロン(DT)、50mgプロピオン酸DT、250mgエナント酸DTを筋注後に放出されるテストステロンおよび内因性テストステロンの血漿中濃度およびFSH血漿中濃度に対する影響
25
社内資料:薬物動態の検討に基づくテストステロン・デポー製剤の評価:Testoviron Depot 100mg製剤各成分のバイオアベイラビリティ
26
織田 明 他:産婦人科の世界. 1956;8(8):81-85