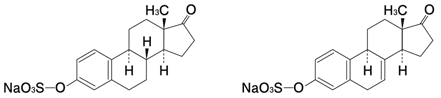
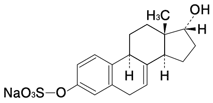
1
Grady D. et al.:Obstet Gynecol. 1995;85(2):304-313[L70010001593]
2
Chlebowski Rowan T. et al.:JAMA. 2003;289(24):3243-3253[L20061107129]
3
The Women's Health Initiative Steering Committee:JAMA. 2004;291(14):1701-1712[L20061107127]
4
Stefanick M L. et al.:JAMA. 2006;295(14):1647-1657[L70010001596]
5
Beral V. et al.:Lancet. 2003;362(9382):419-427 [L20031209108]
6
Manson JoAnn E. et al.:N Engl J Med. 2003;349(6):523-534[L20031006043]
7
Wassertheil-Smoller, S Hendrix. et al. :JAMA. 2003;289(20):2673-2684[L70030038652]
8
Hendrix S L. et al.:Circulation. 2006;113(20):2425-2434[L70010001600]
9
Shumaker Sally A. et al.:JAMA. 2003;289(20):2651-2662[L20040802014]
10
Shumaker Sally A. et al.:JAMA. 2004;291(24):2947-2958[L20040714063]
11
Rodriguez C. et al.:JAMA. 2001;285(11):1460-1465[L70010001603]
12
Lacey J V Jr. et al.:JAMA. 2002;288(3):334-341[L70010001604]
13
Million Women Study Collaborators:Lancet. 2007;369(9574):1703-1710[L70010001605]
14
Anderson Garnet L. et al.:JAMA.2003;290(13):1739-1748[L20031113040]
15
Cirillo Dominic J. et al.:JAMA. 2005;293(3):330-339[L20050427005]
16
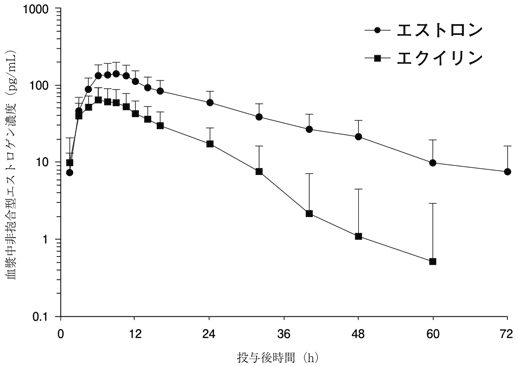
社内資料:血漿中濃度[L20131129001]
17
社内資料:結合型エストロゲンの薬効[L70010001584]