1
Antal EJ, et al.: Int J Clin Pharmacol Ther Toxicol. 1983; 21: 257-259
2
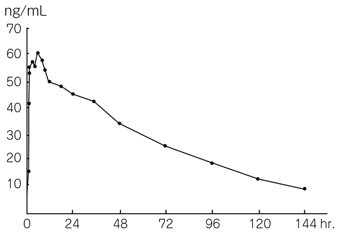
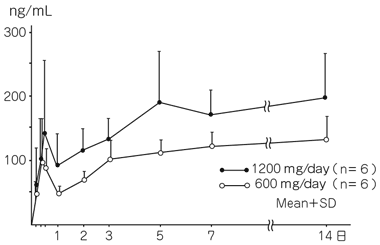
社内資料: 連続投与時における血漿中濃度推移
3
江角凱夫ほか: 薬理と治療. 1985; 13: 1951-1978
4
泉雄勝ほか: 癌の臨床. 1983; 29: 207-211
5
吉田穣ほか: 臨床評価. 1985; 13, 381-418
6
冨永健ほか: 癌と化学療法. 1982; 9: 1994-2004
7
吉田穣ほか: 癌と化学療法. 1985; 12, 516-523
8
栗原操寿ほか: 産婦人科の実際. 1985; 34: 517-536
9
高谷治ほか: 基礎と臨床. 1984; 18: 6162-6168
10
松井義明ほか: 日本産科婦人科学会雑誌. 1985; 37: 1177-1184
11
Di Marco A.Role of Medroxyprogesterone in Endocrine-Related Tumors. Progress in Cancer Research and Therapy. Vol 15. New York: Raven Press; 1980. p1-20
12
善積昇ほか: 日内分泌会誌. 1985; 61: 220-227
13
西谷巌ほか: 日本産科婦人科学会雑誌. 1985; 37: 1161-1168
14
冨永健ほか: 薬理と治療. 1984; 12: 3933-3939
15
野村雍夫ほか: 癌と化学療法. 1985; 12: 844-850