1
Grady D, et al.: Obstet Gynecol. 1995; 85: 304-313
2
Chlebowski RT, et al.: JAMA. 2003; 289: 3243-3253
3
Anderson GL, et al.: JAMA. 2004; 291: 1701-1712
4
Stefanick ML, et al.: JAMA. 2006; 295: 1647-1657
5
Beral V, et al.: Lancet. 2003; 362: 419-427
6
Manson JE, et al.: New Engl J Med. 2003; 349: 523-534
7
Wassertheil-Smoller S, et al.: JAMA. 2003; 289: 2673-2684
8
Hendrix SL, et al.: Circulation. 2006; 113: 2425-2434
9
Shumaker SA, et al.: JAMA. 2003; 289: 2651-2662
10
Shumaker SA, et al.: JAMA. 2004; 291: 2947-2958
11
Rodriguez C, et al.: JAMA. 2001; 285: 1460-1465
12
Lacey JV Jr, et al.: JAMA. 2002; 288: 334-341
13
Beral V, et al.: Lancet. 2007; 369: 1703-1710
14
Anderson GL, et al.: JAMA. 2003; 290: 1739-1748
15
Cirillo DJ, et al.: JAMA. 2005; 293: 330-339
16
Farquhar C, et al.: Cochrane Database Syst Rev. 2017; 5: CD006109
17
Saito K, et al.: Hum Reprod. 2019; 34: 1567-1575
18
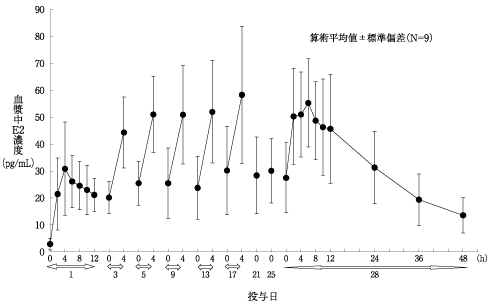
社内資料: 薬物動態(単回投与)(2008年4月16日承認、CTD2.7.2.2.2.1)
19
社内資料: 薬物動態(反復投与)(2008年4月16日承認、CTD2.7.2.2.2.2)
20
社内資料: 更年期障害及び卵巣欠落症状を有する患者を対象とした二重盲検試験(2008年4月16日承認、CTD2.7.6.3.1)
21
社内資料: 骨粗鬆症患者を対象とした二重盲検試験(2008年10月16日承認、CTD2.7.6.3.1)
22
社内資料: 薬効薬理(2008年10月16日承認、CTD2.6.2.2.4.2.1)
23
社内資料: 薬効薬理(2008年10月16日承認、CTD2.6.2.2.4.2.2)
24
社内資料: 薬効薬理(2008年10月16日承認、CTD2.6.2.2.4.2.4)