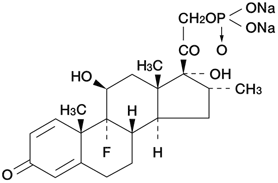
1
Pinsky, L. et al.:Science. 1965;147:402-403
2
中村毅:臨床薬理. 1981;12(1):1-16
3
Thompson, J. et al.:J Exp Med.1970;131(3):429-442
4
梅原千治ほか:ステロイドホルモンV 南江堂1967
5
Bonta, I. L. et al.:Research Release Report No.2 1960
副腎皮質ホルモン剤
1瓶 238円
有効成分 | 1アンプル(0.5mL)中 デキサメタゾンリン酸エステルナトリウムとして 2.2mgデキサメタゾン 1.65mg |
|---|---|
| 添加剤(1mL中) | 亜硫酸水素ナトリウム0.5mg、クレアチニン8mg、パラオキシ安息香酸プロピル0.2mg、パラオキシ安息香酸メチル1.5mg、クエン酸ナトリウム水和物、水酸化ナトリウム |
有効成分 | 1アンプル(1mL)中 デキサメタゾンリン酸エステルナトリウムとして 4.4mgデキサメタゾン 3.3mg |
|---|---|
| 添加剤(1mL中) | 亜硫酸水素ナトリウム0.5mg、クレアチニン8mg、パラオキシ安息香酸プロピル0.2mg、パラオキシ安息香酸メチル1.5mg、クエン酸ナトリウム水和物、水酸化ナトリウム |
有効成分 | 1バイアル(2mL)中 デキサメタゾンリン酸エステルナトリウムとして 8.8mgデキサメタゾン 6.6mg |
|---|---|
| 添加剤(1mL中) | 亜硫酸水素ナトリウム0.5mg、クレアチニン8mg、パラオキシ安息香酸プロピル0.2mg、パラオキシ安息香酸メチル1.5mg、クエン酸ナトリウム水和物、水酸化ナトリウム |
| 剤形 | アンプル |
|---|---|
| pH | 7.0~8.5 |
| 浸透圧比 | 0.7~0.9(生理食塩液に対する比) |
| 性状 | 無色澄明の水性注射剤 |
| 剤形 | アンプル |
|---|---|
| pH | 7.0~8.5 |
| 浸透圧比 | 0.7~0.9(生理食塩液に対する比) |
| 性状 | 無色澄明の水性注射剤 |
| 剤形 | バイアル |
|---|---|
| pH | 7.0~8.5 |
| 浸透圧比 | 0.7~0.9(生理食塩液に対する比) |
| 性状 | 無色澄明の水性注射剤 |
投与方法 | 投与量・投与回数 (デキサメタゾンとして) |
静脈内注射 | 1回1.65~6.6mg、3~6時間毎 |
点滴静脈内注射 | 1回1.65~8.3mg、1日1~2回 |
筋肉内注射 | 1回1.65~6.6mg、3~6時間毎 |
関節腔内注射 | 1回0.66~4.1mg、原則として投与間隔を2週間以上とすること |
軟組織内注射 | 1回1.65~5.0mg、原則として投与間隔を2週間以上とすること |
腱鞘内注射 | 1回0.66~2.1mg、原則として投与間隔を2週間以上とすること |
滑液嚢内注入 | 1回0.66~4.1mg、原則として投与間隔を2週間以上とすること |
硬膜外注射 | 1回1.65~8.3mg、原則として投与間隔を2週間以上とすること |
脊髄腔内注入 | 1回0.83~4.1mg、週1~3回 |
胸腔内注入 | 1回0.83~4.1mg、週1~3回 |
腹腔内注入 | 1回1.65mg |
局所皮内注射 | 1回0.04~0.08mg宛0.83mgまで、週1回 |
結膜下注射 | 1回0.33~2.1mg、 その際の液量は0.2~0.5mLとする |
球後注射 | 1回0.83~4.1mg、 その際の液量は0.5~1.0mLとする |
点眼 | 1回0.21~0.83mg/mL溶液1~2滴、1日3~8回 |
ネブライザー | 1回0.08~1.65mg、1日1~3回 |
鼻腔内注入 | 1回0.08~1.65mg、1日1~3回 |
副鼻腔内注入 | 1回0.08~1.65mg、1日1~3回 |
鼻甲介内注射 | 1回0.66~4.1mg |
鼻茸内注射 | 1回0.66~4.1mg |
喉頭・気管注入 | 1回0.08~1.65mg、1日1~3回 |
中耳腔内注入 | 1回0.08~1.65mg、1日1~3回 |
耳管内注入 | 1回0.08~1.65mg、1日1~3回 |
食道注入 | 1回0.83~1.65mg |
投与方法 | 投与量・投与回数 (デキサメタゾンとして) |
点滴静脈内注射 | ビンクリスチン硫酸塩、ドキソルビシン塩酸塩との併用において、デキサメタゾンの投与量及び投与法は、通常1日量デキサメタゾンを33mgとし、21日から28日を1クールとして、第1日目から第4日目、第9日目から第12日目、第17日目から第20日目に、投与する。 なお、投与量及び投与日数は、年齢、患者の状態により適宜減ずる。 |
投与方法 | 投与量・投与回数 (デキサメタゾンとして) |
静脈内注射 点滴静脈内注射 | 通常、成人には1日3.3~16.5mgを、1日1回又は2回に分割して投与する。 ただし、1日最大16.5mgまでとする。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
デスモプレシン酢酸塩水和物 ミニリンメルト(男性における夜間多尿による夜間頻尿) | 低ナトリウム血症が発現するおそれがある。 | 機序不明 |
〈本剤全身投与の患者〉 ダクラタスビル塩酸塩 ダクルインザ アスナプレビル スンベプラ 〈本剤全身投与の患者(ただし単回投与の場合を除く)〉 リルピビリン塩酸塩 エジュラント リルピビリン塩酸塩・テノホビル アラフェナミドフマル酸塩・エムトリシタビン オデフシィ ドルテグラビルナトリウム・リルピビリン塩酸塩 ジャルカ | これらの薬剤の血中濃度を低下させ、作用を減弱させるおそれがある。 | 本剤のCYP3A4誘導作用により、これらの薬剤の代謝が促進される可能性がある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
バルビツール酸誘導体 フェノバルビタール リファンピシン カルバマゼピン | 本剤の作用が減弱することが報告されている。 | これらの薬剤がチトクロームP450を誘導し、本剤の代謝が促進される。 |
フェニトイン | 本剤の作用が減弱することが報告されている。 | フェニトインがチトクロームP450を誘導し、本剤の代謝が促進される。 |
フェニトイン | 併用により、フェニトインの血中濃度が上昇又は低下するとの報告がある。 | 機序不明 |
サリチル酸誘導体 アスピリン等 | 併用時に本剤を減量すると、血清中のサリチル酸誘導体の濃度が増加し、サリチル酸中毒を起こすことが報告されている。 | 本剤はサリチル酸誘導体の腎排泄と肝代謝を促進し、血清中のサリチル酸誘導体の濃度が低下する。 |
抗凝血剤 ワルファリンカリウム | 抗凝血剤の作用を減弱させることが報告されている。 | 本剤は血液凝固促進作用がある。 |
糖尿病用薬 ビグアナイド系薬剤 スルホニルウレア剤 速効型インスリン分泌促進剤 α-グルコシダーゼ阻害剤 チアゾリジン系薬剤 DPP-4阻害剤 GLP-1受容体作動薬 SGLT2阻害剤 インスリン製剤等 | これらの薬剤の作用を減弱させることが報告されている。 | 本剤は肝臓での糖新生を促進し、末梢組織での糖利用を阻害する。 |
血圧降下剤 | これらの薬剤の作用を減弱させるおそれがある。 | 機序不明 |
利尿剤 | これらの薬剤の作用を減弱させるおそれがある。 | 機序不明 |
利尿剤(カリウム保持性利尿剤を除く) トリクロルメチアジド フロセミド | 併用により、低カリウム血症があらわれることがある。 | 本剤は尿細管でのカリウム排泄促進作用がある。 |
シクロスポリン | 副腎皮質ホルモン剤の大量投与により、併用したシクロスポリンの血中濃度が上昇するとの報告がある。 | シクロスポリンの代謝を阻害する。 |
マクロライド系抗生物質 エリスロマイシン アゾール系抗真菌剤 イトラコナゾール | 副腎皮質ホルモン剤の作用が増強されるとの報告がある。 | 本剤の代謝が阻害されるおそれがある。 |
HIVプロテアーゼ阻害剤 サキナビルリトナビル等 | 本剤のAUCの上昇あるいはこれらの薬剤のAUCが低下するおそれがある。 | チトクロームP450に対して競合する可能性がある。また、本剤がチトクロームP450を誘導することより、これらの薬剤の代謝が促進される可能性がある。 |
エフェドリン | 副腎皮質ホルモン剤の代謝が促進され、血中濃度が低下するとの報告がある。 | 機序不明 |
サリドマイド | 海外において、多発性骨髄腫における本剤との併用により、中毒性表皮壊死症(Lyell症候群)が発現したとの報告がある。 | 機序不明 |
頻度不明 | |
|---|---|
内分泌 | 月経異常 |
消化器 | 下痢、悪心・嘔吐、胃痛、胸やけ、腹部膨満感、口渇、食欲不振、食欲亢進 |
精神神経系 | 多幸症、不眠、頭痛、めまい |
筋・骨格 | 筋肉痛、関節痛 |
投与部位 | 〈関節腔内投与〉 関節の不安定化注1)、疼痛・腫脹・圧痛の増悪 〈筋肉内又は皮内投与〉 組織の萎縮による陥没(局所) |
脂質・蛋白質代謝 | 満月様顔貌、野牛肩、窒素負平衡、脂肪肝 |
体液・電解質 | 浮腫、血圧上昇、低カリウム性アルカローシス |
眼 | 中心性漿液性網脈絡膜症等による網膜障害、眼球突出 |
血液 | 白血球増多 |
皮膚 | ざ瘡、多毛、脱毛、色素沈着、皮下溢血、紫斑、線条、そう痒、発汗異常、顔面紅斑、紅斑、創傷治癒障害、皮膚菲薄化・脆弱化、脂肪織炎 |
その他 | 発熱、疲労感、ステロイド腎症、体重増加、精子数及びその運動性の増減、しゃっくり、刺激感(ピリピリした痛み、しびれ、ひきつり感等)注2) |