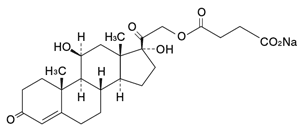
1
Vimala J,et al.:Int J Cardiol.2011;150(3):e94-95
2
Feldweg AM,et al.:J Clin Rheumatol.1999;5(3):143-150
3
Horn JR,et al.:Pharm Times.2008;74(9):37
4
Melby JC,et al.:Metabolism.1961;10:75-82
5
Melby JC,et al.:J Clin Invest.1958;37(12):1791-1798
6
社内資料:ラットにおける薬物動態[L20041130034]
7
Weissmann G,et al.:J Exp Med.1962;116(4):433-450
8
Schumer W,et al.:JAMA.1968;205(4):215-219
9
Lefer AM,et al.:Clin Pharmacol Ther.1970;11(5):630-655
10
Gewurz H,et al.:Nature.1965;208(5012):755-757
11
Rukes JM,et al.:Ann N Y Acad Sci.1955;61(2):448-459