1
Watanabe A.et al.:J Toxicol.Sci.2012;37(3):617-629
2
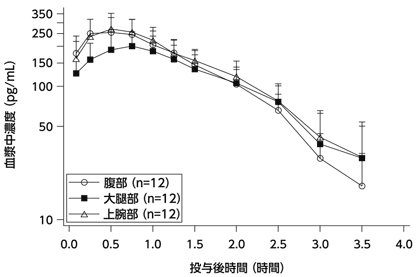
社内資料:113試験
3
Kumagai Y.et al.:Clin Pharmacol Drug Dev. 2019(doi: 10.1002/cpdd.687)
4
社内資料:健康成人男性での単回静脈内投与試験(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.7.1.2)
5
社内資料:薬物動態試験<血球移行性(in vitro)>(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.6.4.4)
6
Serada M.et al.:Xenobiotica,2012;42(4):398-407
7
社内資料:健康高齢女性での臨床薬理試験(QT/QTc間隔に及ぼす影響の検討)(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.7.6.7)
8
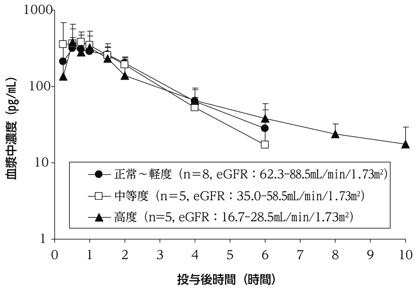
社内資料:腎機能障害者での臨床薬理試験(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.6.4.5)
9
社内資料:薬物動態試験<酵素阻害(in vitro)>(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.6.4.5)
10
社内資料:薬物動態試験<酵素誘導(in vitro)>(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.7.2.2)
11
Sugimoto T.et al.:Osteoporos Int.2019;30(11):2321–2331
12
社内資料:骨折リスクの高い原発性骨粗鬆症に対するMN-10-Tの第Ⅲ相骨折試験(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.7.6.10)
13
Nakamura T.et al.:J Clin Endocrinol Metab.2012;97(9):3097-3106
14
社内資料:骨折の危険性の高い原発性骨粗鬆症に対するMN-10-Tの第Ⅲ相骨量試験
15
Isogai Y.et al.:J Bone Miner Res.1996;11(10):1384-1393
16
社内資料:卵巣摘除ラットにおける骨形成促進作用(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.6.2.3)
17
社内資料:卵巣摘除カニクイザルを用いた18ヵ月間反復投与試験(テリボン皮下注用56.5μg:2011年9月26日承認、CTD2.6.2.3)
18
Takao-Kawabata R.et al.:Calcif Tissue Int.2015;97(2):156-168
19
Sugie-Oya A.et al.:J Bone Miner Metab.2016;34(3):303-314