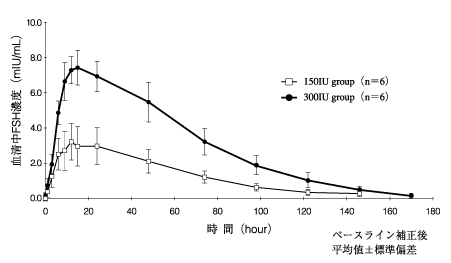
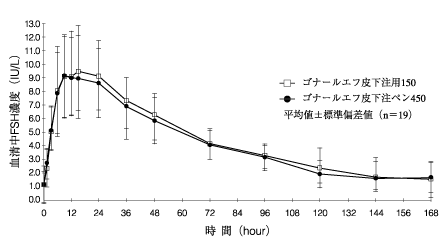
1
Bussi R, et al.:薬理と治療.1995; 23(8), 1953-1977
2
社内資料:乳汁中への分泌(ラット)(2009年7月7日承認、CTD2.6.4.5)
3
Parazzini F, et al.:Gynecol Oncol. 1998 Mar;68(3):226-8
4
Burkman R.T, et al.:Fertil Steril. 2003 Apr;79(4):844-51.
5
Jensen A, et al.:Cancer Epidemiol Biomarkers Prev. 2007 Jul;16(7):1400-7.
6
Rupinder K.R, et al.:Med J Malaysia. 2006 Mar;61(1):132-7.
7
Hansen M, et al.:N Engl J Med. 2002 Mar 7;346(10):725-30.
8
Bonduelle M, et al.:Hum Reprod. 2002 Mar;17(3):671-94.
9
Peschka B, et al.:Hum Reprod. 1999 Sep;14(9):2257-63.
10
Merlob P, et al.:Eur J Med Genet. 2005 Jan-Mar;48(1):5-11.
11
社内資料:健康成人女性における薬物動態(単回)(2009年7月7日承認、CTD2.7.6.2)
12
社内資料:健康成人女性における薬物動態(反復)(2009年7月7日承認、CTD2.7.6.3)
13
社内資料:生物学的同等性試験(2008年10月22日承認、CTD2.7.1.2)
14
社内資料:健康成人男性における薬物動態(反復)(2006年1月23日承認、CTD2.7.2.2)
15
Taketani Y, et al.:Reprod Med Biol. 2010 Feb 23;9(2):99-106.
16
Taketani Y, et al.:Reprod Med Biol. 2009 Dec 23;9(2):91-7.
17
岡田弘ほか:ホルモンと臨床. 2006; 54(8), 725-732
18
Bouloux P, et al.:Fertil Steril. 2002 Feb;77(2):270-3.
19
Liu P. Y, et al.:Hum Reprod. 1999 Jun;14(6):1540-5.
20
Warne DW, et al.:Fertil Steril. 2009 Aug;92(2):594-604.
21
ZelinsKi-Wooten M.B, et al.: Hum Reprod. 1995 Jul;10(7):1658-66.
22
Hikim AP, et al.:Endocrinology. 1995 Jan;136(1):253-61.