1
棟方昭博 他:薬理と治療 1994;22(Suppl.10):S2585-S2605
2
棟方昭博 他:薬理と治療 1994;22(Suppl.10):S2509-S2530
3
棟方昭博 他:薬理と治療 1994;22(Suppl.10):S2531-S2554
4
棟方昭博 他:薬理と治療 1994;22(Suppl.10):S2555-S2583
5
棟方昭博 他:薬理と治療 1994;22(Suppl.10):S2607-S2624
6
Miner, P. et al.:Dig. Dis. Sci. 1995;40(2):296-304
7
Morice, A.H. et al.:Lancet. 1997;350:1105
8
Kapur, K.C. et al.:Gut. 1995;37:838-839
9
竹下宗範 他:第74回日本消化器病学会九州支部例会抄録 1999;74:65
10
Mehta, R.P.:CMAJ. 1990;143(10):1031-1032
11
Witte, T. et al.:Nephron. 1994;67:481-482
12
Smilde, T.J. et al.:Ned. Tijdschr. Geneeskd. 1994;138(51):2557-2561
13
Otsubo, H. et al.:Int. J. Hematol. 1998;68:445-448
14
Kotanagi, H. et al.:J. Gastroenterol. 1998;33:571-574
15
Casellas, F. et al.:J. Clin. Gastroenterol. 1996;22(2):160-161
16
Daneshmend, T.K.:Lancet. 1991;337:1297-1298
17
Jick, H. et al.:Pharmacotherapy. 1995;15(2):176-181
18
Committee on Safety of Medicines:Current Problems in Pharmacovigilance. 1995;21:5-6
19
Bodin, F. et al.:Therapie. 1991;46:341
20
Wyatt, S. et al.:Lancet. 1993;341:1476
21
Hautekeete, M.L. et al.:Gastroenterology. 1992;103:1925-1927
22
Stoschus, B. et al.:J. Hepatol. 1997;26:425-428
23
Deltenre, P. et al.:Gut. 1999;44:886-888
24
Besseau, M. et al.:Gastroenterol. Clin. Biol. 1991;15:174-175
25
Sachedina, B. et al.:Ann. Intern. Med. 1989;110(6):490-492
26
棟方昭博 他:薬理と治療 1994;22(Suppl.10):S2625-S2638
27
Mulder, C.J.J. et al.:Ann. Intern. Med. 1988;106(6):911-912
28
太田隆雄 他:応用薬理 1994;47(6):513-522
29
田中和彦 他:応用薬理 1994;48(4):225-238
30
de Boer, N.K.H. et al.:Am. J. Gastroenterol. 2007;102:2747-2753
31
Szumlanski, C.L. et al.:Br. J. Clin. Pharmacol. 1995;39:456-459
32
Dewit, O. et al.:Aliment. Pharmacol. Ther. 2002;16:79-85
33
Honeybourne, D.:BMJ. 1994;308:533-534
34
Welte, T. et al.:Lancet. 1991;338:1273
35
Lagler, U. et al.:Schweiz. Med. Wochenschr. 1992;122:1332-1334
36
Bitton, A. et al.:Am. J. Gastroenterol. 1996;91:1039-1040
37
Declerck, D. et al.:Rev. Mal. Respir. 1994;11:292-293
38
Muzzi, A. et al.:Chest. 1995;108(4):1181
39
Reinoso, M.A. et al.:Chest. 1992;101(5):1469-1471
40
le Gros, V. et al.:BMJ. 1991;302:970
41
Kristensen, K.S. et al.:Lancet. 1990;335:605
42
Agnholt, J. et al.:Lancet. 1989;1:1135
43
増谷学 他:日本消化器病学会雑誌 1999;96(5):524-529
44
Heresbach, D. et al.:Gastroenterol. Clin. Biol. 1994;18:782-785
45
Gujral, N. et al.:Dig. Dis. Sci. 1996;41(3):624-626
46
Iaquinto, G. et al.:Ital. J. Gastroenterol. 1994;26:145-147
47
Skhiri, H. et al.:Nephron. 1998;79:236
48
Netzer, P.:Schweiz. Med. Wochenschr. 1995;125:2438-2442
49
Dent, M.T.:BMJ. 1992;305:159
50
Timsit, M.A. et al.:Rev. Rhum. Engl. Ed. 1997;64(10):586-588
51
Woodward, D.K.:BMJ. 1989;299:1224
52
Bondesen, S. et al.:Scand. J. Gastroenterol. 1984;19:677-682
53
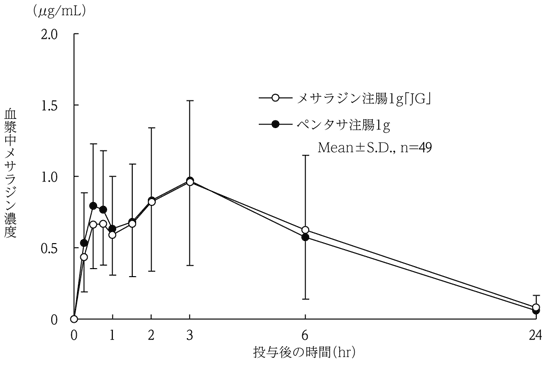
社内資料:生物学的同等性試験
54
第十八改正 日本薬局方解説書 廣川書店 2021;C5626-C5633
55
Brown, J. et al.:Aliment. Pharmacol. Ther. 1997;11:685-691
56
Danish 5-ASA Group:Dig. Dis. Sci. 1987;32(6):598-602
57
Hanauer, S.B.:Inflamm. Bowel. Dis. 1998;4:79-83
58
用量反応性及び比較試験(海外第Ⅱ相試験)(ペンタサ注腸:2002年10月8日承認、申請資料概要 ト.1.(2)2)
59
中丸幸一 他:日本薬理学雑誌 1994;104:447-457
60
藤原豊博:薬理と治療 2010;38(9):787-804
61
小島僚太郎 他:日本薬理学雑誌 2001;118:123-130
62
動物モデルにおけるメサラジンの障害抑制効果(ペンタサ注腸:2002年10月8日承認、申請資料概要 ホ.1.(1))