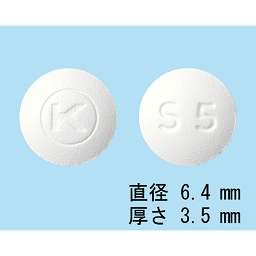
1
社内資料:健康成人を対象とした生物学的同等性試験[文献参照番号][86570]
2
蓮沼智子ほか:薬理と治療.2007;35(suppl.2):S123-130[文献参照番号][58282]
3
社内資料:血漿中代謝酵素の検討(2005年7月25日承認、申請資料概要ヘ.2.3.2)[文献参照番号][16439]
4
社内資料:モノ水酸化代謝物(SS097)生成に関与する代謝酵素の同定(2005年7月25日承認、申請資料概要ヘ.2.3.3)[文献参照番号][16440]
5
社内資料:CYP典型基質代謝に与える影響(2005年7月25日承認、申請資料概要ヘ.2.5.1)[文献参照番号][16441]
6
社内資料:クマリン7-水酸化活性に対する影響及び阻害の可逆性(2005年7月25日承認、申請資料概要ヘ.2.5.2)[文献参照番号][16442]
7
社内資料:腎機能低下者を対象とした海外臨床薬理試験(2005年7月25日承認、申請資料概要ヘ.3.5)[文献参照番号][16438]
8
社内資料:肝機能低下者を対象とした海外臨床薬理試験(2005年7月25日承認、申請資料概要ヘ.3.4)[文献参照番号][16437]
9
放射線治療後の慢性期の口腔乾燥症患者を対象とした第III相二重盲検比較試験(2005年7月25日承認、申請資料概要ト.1.3.2)
10
社内資料:放射線治療後の慢性期の口腔乾燥症患者を対象とした長期投与試験(2005年7月25日承認、申請資料概要ト.1.4.2)[文献参照番号][16443]
11
社内資料:口腔乾燥症を有するシェーグレン症候群患者を対象とした第III相検証試験(2007年10月19日承認、CTD 2.7.6.3)[文献参照番号][16444]
12
口腔乾燥症を有するシェーグレン症候群患者を対象とした長期投与試験(2007年10月19日承認、CTD 2.7.6.7)
13
Baum, B. J. et al.:Biology of the salivary glands, CRC press, Florida.1993:153-179[文献参照番号][51251]
14
浅利哲也ほか:薬理と治療.2007;35(suppl.2):S111-122[文献参照番号][58281]
15
丸山和容ほか:日本薬理学雑誌.2006;127(5):399-407[文献参照番号][53498]
16
Omori, Y. et al.:Arzneim. Forsch./Drug Res.2003;53(5):342-350[文献参照番号][42286]
17
Iwabuchi, Y. et al.:Asia Pac. J. Pharmacol.1992;7(4):271-276[文献参照番号][15139]
18
Glenert, U.:Eur. J. Pharmacol.1992;226(1):43-52[文献参照番号][15148]