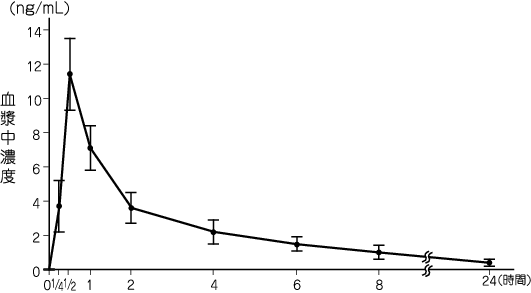
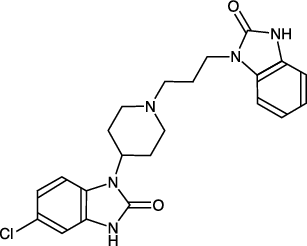
1
社内資料: 10mg錠及び5mg錠の生物学的同等性について(1982年6月15日承認、申請資料概要へ.Ⅱ.3.)
2
Heykants J, et al.: Eur J Drug Metab Pharmacokinet. 1981; 6: 61-70
3
Michiels M, et al.: Eur J Drug Metab Pharmacokinet. 1981; 6: 37-48
4
社内資料: ドンペリドンの代謝について
5
Meuldermans W, et al.: Eur J Drug Metab Pharmacokinet. 1981; 6: 49-60
6
Yoshizato T, et al.: Eur J Clin Pharmacol. 2012; 68: 1287-1294
7
三好秋馬ほか: 診療と新薬. 1980; 17: 2923-2933
8
棟久龍夫ほか: 医学と薬学. 1980; 3: 867-875
9
長岡正範ほか: 新薬と臨床. 1980; 29: 1818-1843
10
岩波文門ほか: 小児科臨床. 1981; 34: 931-938
11
前田和一ほか: 新薬と臨床. 1980; 29: 1845-1849
12
藤井一元ほか: 日平滑筋誌. 1980; 16: 37-46
13
Schuurkes JAJ, et al.: Scand J Gastroenterol. 1981; 16: 33-36
14
Harasawa S, et al.: 内科宝函. 1981; 28: 67-75
15
原沢茂ほか: 臨床成人病. 1983; 13: 2313-2317
16
本郷道夫ほか: 医学と薬学. 1980; 4: 665-668
17
白羽誠ほか: 医学と薬学. 1980; 4: 533-537
18
周藤勝一ほか: 応用薬理. 1981; 21: 179-189
19
Shuto K, et al.: J Pharm Dyn. 1980; 3: 709-714
20
Niemegeers CJE, et al.: Arch Int Pharmacodyn Ther. 1980; 244: 130-140