1
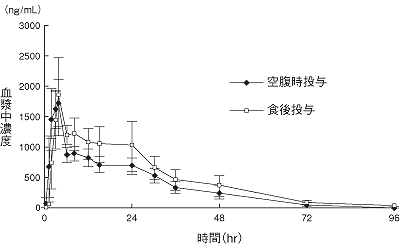
小野薬品工業:国内成人第Ⅰ相試験(社内資料;2009年10月16日承認、CTD2.7.2.2)
2
高橋利明ほか:Cancer Chemother.Pharmacol.,2011;68:653-659
3
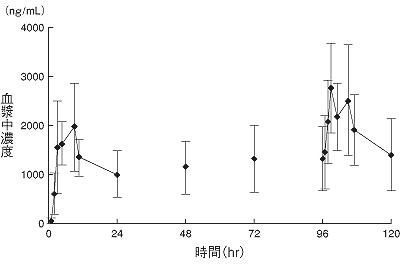
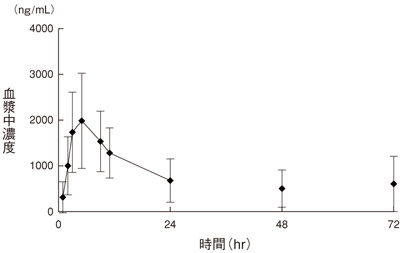
小野薬品工業:国内小児癌患者PK試験&第Ⅲ相一般臨床試験(社内資料;2012年6月22日承認、CTD2.7.6.2)
4
Majumdar A.K.et al.:J.Clin.Pharmacol.,2006;46:291-300
5
Sanchez R.I.et al.:Drug Metab.Dispos.,2004;32:1287-1292
6
Bergman A.J.et al.:Clin.Pharmacokinet.,2005;44:637-647
7
Majumdar A.K.et al.:Clin.Pharmacol.Ther.,2003;74:150-156
8
Majumdar A.K.et al.:J.Clin.Pharmacol.,2007;47:744-750
9
Shadle C.R.et al.:J.Clin.Pharmacol.,2004;44:215-223
10
中出 進ほか:Cancer Chemother.Pharmacol.,2008;63:75-83
11
McCrea J.B.et al.:Clin.Pharmacol.Ther.,2003;74:17-24
12
Depré M.et al.:Eur.J.Clin.Pharmacol.,2005;61:341-346
13
Blum R.A.et al.:Clin.Ther.,2003;25:1407-1419
14
Feuring M.et al.:J.Clin.Pharmacol.,2003;43:912-917
15
Nygren P.et al.:Cancer Chemother.Pharmacol.,2005;55:609-616
16
Loos W.J.et al.:Cancer Chemother.Pharmacol.,2007;59:407-412
17
高橋利明ほか:Cancer Sci.,2010;101:2455-2461
18
Chawla S.P.et al.:Cancer,2003;97:2290-2300
19
Hesketh P.J.et al.:J.Clin.Oncol.,2003;21:4112-4119
20
Poli-Bigelli S.et al.:Cancer,2003;97:3090-3098
21
Warr D.G.et al.:J.Clin.Oncol.,2005;23:2822-2830
22
Gore L.et al.:Pediatr.Blood Cancer,2009;52:242-247
23
小野薬品工業:NK1受容体拮抗作用(社内資料; 2009年10月16日承認、CTD2.6.2.2)
24
Tattersall F.D.et al.:Neuropharmacology,2000;39:652-663
25
小野薬品工業:アポモルヒネ及びモルヒネ誘発嘔吐抑制作用(社内資料; 2009年10月16日承認、CTD2.6.2.2)