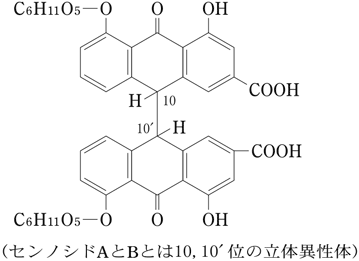
1
Masao,H. et al.:Pharmacology. 1988;36(Supp.1):172-179
2
伊藤文雄 他:薬理と治療. 1975;3(5):855-872
3
山本照晃:診療と新薬. 1982;19(10):2922-2924
4
鶴岡信博 他:産婦人科の世界. 1982;34(7):741-743
5
鈴木俊彦:診療と新薬. 1984;21(4):783-787
6
大郷勝三 他:医学と薬学. 1984;11(5):1425-1428
7
千村哲郎:産婦人科の世界. 1984;36(8):643-645
8
陰山克 他:新薬と臨床. 1985;34(8):1431-1435
9
Sasaki,K.et al.:Planta Medica. 1979;37(4):370-378
10
Fairbairn,J.W.et al.:Nature. 1951;167(4259):988
11
Fairbairn,J.W.et al.:J.Pharm.Pharmacol. 1951;3(12):918-925
12
木佐佳世子 他:日本生薬学会第27回年会1980
13
Lemmens,L.et al.:J.Pharm.Pharmacol. 1976;28(6):498-501
14
Garcia-Villar,R.et al.:J.Pharm.Pharmacol. 1980;32(5):323-329
15
Leng-Peschlow,E,:J.Pharm.Pharmacol. 1980;32(5):330-335