1
EAファーマ株式会社:社内資料(毒性試験「生殖発生毒性試験」)(2018年1月19日承認、申請資料概要2.6.6.6)
2
EAファーマ株式会社:社内資料(乳汁への移行性)(2018年1月19日承認、申請資料概要2.6.4.6)
3
EAファーマ株式会社:社内資料(トランスポーターに関する検討)(2018年1月19日承認、申請資料概要2.7.2.2)
4
EAファーマ株式会社:社内資料(薬物相互作用の検討)(2018年1月19日承認、申請資料概要2.7.2.2)
5
EAファーマ株式会社:社内資料(慢性便秘患者を対象とした臨床薬理試験)(2018年1月19日承認、申請資料概要2.7.2.2)
6
EAファーマ株式会社:社内資料(外国臨床試験における代謝動態の確認)(2018年1月19日承認、申請資料概要2.7.2.2)
7
EAファーマ株式会社:社内資料(血漿蛋白結合率および血球移行率)(2018年1月19日承認、申請資料概要2.7.2.2)
8
EAファーマ株式会社:社内資料(排泄率の検討)(2018年1月19日承認、申請資料概要2.7.2.2)
9
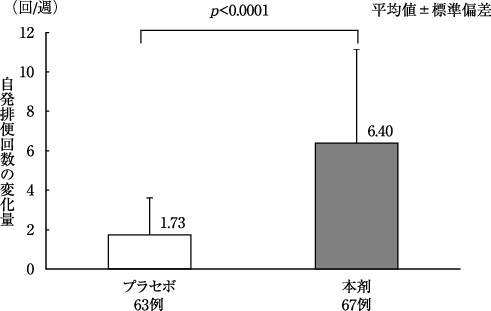
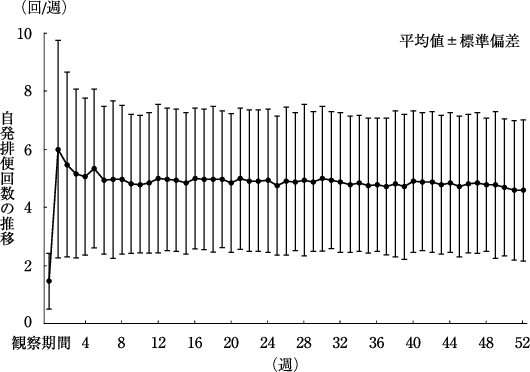
Nakajima A., et al.:Lancet Gastroenterol. Hepatol., 2018;3(8):537-547
10
EAファーマ株式会社:社内資料(胆汁酸トランスポーターに対する作用)(2018年1月19日承認、申請資料概要2.6.2.2)
11
EAファーマ株式会社:社内資料(胆汁酸吸収に対する作用)(2018年1月19日承認、申請資料概要2.6.2.2)
12
Acosta A., et al.:Ther. Adv. Gastroenterol., 2014;7(4):167-175
13
Iser J. H., et al.:Drugs, 1981;21(2):90-119
14
Mitchell W. D., et al.:Gut, 1973;14(5):348-353
15
EAファーマ株式会社:社内資料(ラットロペラミド誘発便秘モデルに対する作用)(2018年1月19日承認、申請資料概要2.6.2.2)