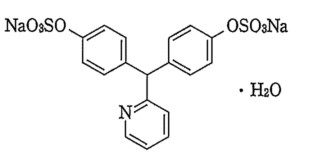
1
Jauch R, et al.: Arzneim-Forsch. 1977; 27(5): 1045-50.
2
大沼規男ほか.: 医薬品研究. 1977; 8(4): 485-90.
3
大沼規男ほか.: 医薬品研究. 1977; 8(4): 474-84.
4
川井啓市ほか.: 新薬と臨牀. 1977; 26(4): 593-604.
5
国分義行ほか.: 小児科診療. 1977; 40(4): 490-5.
6
笹川 力ほか.: Therapeutic Research. 1990; 11(9): 3207-15.
7
笹川 力ほか.: Therapeutic Research. 1990; 11(9): 3217-28.
8
鶴見介登ほか.: 応用薬理. 1977; 14(4): 549-55.
9
Jauch R, et al.: Arzneim-Forsch. 1975; 25(11): 1796-800.
10
Pala G, et al.: Arch Int Pharmacodyn. 1966; 164(2): 356-69.
11
Forth W, et al.: Naunyn-Schmiedeberg's Arch Pharmacol. 1972; 274(1): 46-53.